Número atual: 24(3) - Setembro 2024
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Associação entre as possíveis intervenções para tratamento de persistência do canal arterial e desenvolvimento de displasia broncopulmonar em prematuros com muito baixo peso
Association between possible interventions for the treatment of patent ductus arteriosus and development of bronchopulmonary dysplasia in very low birth weight prematures
Júlia Piano-Seben1,2,3; Natália Piano-Seben4,5; Cristiane Agostini-Cassanelo6,7,8,9; Luísa Soares-Capa10; Eloisa Piano-Cerutti10
DOI:10.31365/issn.2595-1769.v24i3p68-74
1. Universidade Estadual de Campinas (UNICAMP), Endocrinologia Pediátrica - Campinas - São Paulo - Brasil.
2. Universidade Federal da Fronteira Sul (UFFS - HSVP), Pediatria - Passo Fundo - Rio Grande do Sul - Brasil
3. Universidade de Passo Fundo (UPF), Medicina - Passo Fundo - Rio Grande do Sul - Brasil
4. Hospital Universitário de Santa Maria (HUSM), Ginecologia e Obstetrícia - Santa Maria - Rio Grande do Sul - Brasil
5. Universidade do Sul de Santa Catarina, Medicina - Palhoça - Santa Catarina - Brasil
6. Hospital da Criança Santo Antônio do Complexo Hospitalar Santa Casa de Porto Alegre, Pediatria - Porto Alegre - Rio Grande do Sul - Brasil.
7. Hospital São Lucas da PUCRS, Neonatologia - Porto Alegre - Rio Grande do Sul - Brasil
8. Fundação Universidade Federal de Ciências da Saúde de Porto Alegre, Medicina - Porto Alegre - Rio Grande do Sul - Brasil
9. Hospital São Vicente de Paulo de Passo Fundo, Pediatria, Neonatologia - Passo Fundo - Rio Grande do Sul - Brasil
10. Universidade Federal de Santa Maria (UFSM), Medicina - Santa Maria - Rio Grande do Sul - Brasil
Endereço para correspondência:
Instituição: Hospital Universitário de Santa Maria (HUSM), Ginecologia e Obstetrícia - Santa Maria - Rio Grande do Sul - Brasil
Recebido em: 05/01/2024
Aprovado em: 08/08/2024
Resumo
OBJETIVO: Avaliar a incidência de persistência do canal arterial (PCA) nos recém-nascidos prematuros (RNPTs) de muito baixo peso internados na Unidade de Terapia Intensiva (UTI) Neonatal de um hospital de referência estadual, bem como as características dos portadores desta patologia, a terapia utilizada e o desenvolvimento de displasia broncopulmonar (DBP).
MÉTODOS: Estudo de coorte retrospectivo, no qual foram incluídos 516 RNPTs de muito baixo peso internados na UTI Neonatal de janeiro de 2016 a dezembro de 2020. As variáveis foram analisadas primariamente conforme a presença ou ausência de PCA e posteriormente conforme o tratamento adotado.
RESULTADOS: Dos 516 RNPTs incluídos no estudo, 30,23% eram portadores de PCA, com peso médio de 957,5g e idade gestacional média de 27,3 semanas. A incidência de DBP foi de 69,35% (90/130) na amostra, sendo que os paciente submetidos aos tratamentos medicamentoso e cirúrgico tiveram incidência de 67,6% e 100%, respectivamente, enquanto os pacientes submetidos ao tratamento conservador tiveram uma incidência de 59,1%.
CONCLUSÃO: Evidenciou-se relação inversamente proporcional entre a incidência de PCA e as características neonatais, sendo a prematuridade o principal fator de risco, e a realização de corticoterapia um fator protetor importante frente ao desenvolvimento desta cardiopatia. Quanto ao manejo terapêutico e a associação com DBP, apesar dos resultados estatisticamente significativos, mais estudos são necessários para definir a abordagem terapêutica ideal e o equilíbrio entre riscos e benefícios.
Palavras-chave: Recém-Nascido Prematuro. Permeabilidade do Canal Arterial. Displasia Broncopulmonar. Unidades de Terapia Intensiva Neonatal.
Abstract
OBJECTIVE: To evaluate the incidence of patent ductus arteriosus (PDA) in very low birth weight (VLBW) premature newborns admitted to the Neonatal Intensive Care Unit (NICU) of a state reference hospital, as well as the characteristics of those with this pathology, the therapy used and the development of bronchopulmonary dysplasia (BPD).
METHODS: Retrospective cohort study, in which 516 VLBW newborns admitted to the NICU from January 2016 to December 2020 were included. The variables were analyzed primarily according to the presence or absence of PDA and, subsequently, according to the treatment adopted.
RESULTS: From 516 preterm infants included in the study, 30.23% had PDA, with an average weight of 957.5g and an average gestational age of 27.3 weeks. The incidence of BPD was 69.35% (90/130) in the sample, with patients undergoing medical and surgical treatments having an incidence of 67.6% and 100%, respectively, while patients undergoing conservative treatment had an incidence of incidence of 59.1%.
CONCLUSION: An inversely proportional was evidenced between the incidence of PDA and neonatal characteristics, with prematurity being the main risk factor, and the use of corticosteroid therapy an important protective factor against the development of this heart disease. Regarding therapeutic management and the association with BPD, despite the statistically significant results, more studies are needed to define the ideal therapeutic approach and the balance between risks and benefits.
Keywords: Ductus Arteriosus, Patent. Ductus Arteriosus. Premature Birth. Bronchopulmonary Dysplasia.
INTRODUÇÃO
O sistema circulatório fetal difere anatômica e funcionalmente do extrauterino. No feto, a oxigenação sanguínea é realizada pela placenta e o ducto arterioso permite a passagem do sangue oxigenado da artéria pulmonar diretamente para a artéria aorta.1 Devido à alta resistência pulmonar fetal ao fluxo sanguíneo, este órgão recebe um aporte mínimo de sangue oxigenado. Normalmente, em até 72 horas após o nascimento, ocorre o fechamento espontâneo do ducto arterioso e os alvéolos pulmonares se tornam responsáveis pelo processo de oxigenação sanguínea. Contudo, pode ocorrer uma falha nesse mecanismo de adaptação do sistema circulatório, desenvolvendo uma complicação denominada persistência do canal arterial (PCA).2
Ao avaliar a prevalência das cardiopatias congênitas existentes, observa-se que a PCA corresponde a aproximadamente 10% da totalidade,3 podendo coexistir com outras cardiopatias e sendo classificada como acianótica.4 Suspeita-se dessa patologia na presença de sinais clínicos como sopro sistólico ou contínuo, pressão arterial diastólica baixa, pressão de pulso ampla, taquicardia, hipotensão, insuficiência cardíaca e/ou dificuldade respiratória, ou na presença de sinais radiológicos como edema pulmonar e/ou cardiomegalia, devendo-se realizar ecocardiografia para confirmação do diagnóstico.2,5,6
A prematuridade é o principal determinante para o desenvolvimento da PCA, sendo a prevalência dessa patologia inversamente proporcional ao peso e à idade gestacional (IG) ao nascer.2. Evidenciam-se, em âmbito mundial, ao analisar recém-nascidos prematuros (RNPTs) com IG inferior a 30, 28 e 24 semanas, incidências aproximadas de 30%, 70% e 80%, respectivamente.7-9 Outros fatores de risco relacionados são: asfixia, sepse, ruptura prolongada de membranas, síndrome do desconforto respiratório, reposição volêmica superior a 170ml/kg/dia na primeira semana de vida, uso de furosemida e fototerapia.5,7,10 Fatores como hipertensão materna e uso de corticosteroide antenatal atuam como protetores frente ao desenvolvimento desta cardiopatia.5
Como consequência à patência do canal arterial, ocorre a formação de um shunt da esquerda para a direita, aumentando o fluxo sanguíneo pulmonar que, somado à disfunção ventilatória do prematuro, pode resultar em edema pulmonar e diminuição da complacência deste órgão. Ademais, com a sobrecarga volumétrica do ventrículo esquerdo, há congestão pulmonar. Esses fatores estão associados ao aumento da necessidade de suporte ventilatório e, consequentemente, aumento da incidência de displasia broncopulmonar (DBP).11
Por ser uma patologia frequente na prática clínica das UTI Neonatais, diferentes estratégias terapêuticas para recém-nascidos com PCA estão sendo estudadas, com maior foco para as abordagens consideradas menos invasivas, como o tratamento conservador e o farmacológico.12,13 O manejo cirúrgico desta patologia consiste no fechamento do ducto arterioso com clipes vasculares ou por meio de sutura.14. Porém, por ter sido associado a complicações como paralisia de cordas vocais,15 paralisia diafragmática,16 instabilidade hemodinâmica,17 desenvolvimento de DBP18 e comprometimento do desenvolvimento neurológico, o tratamento cirúrgico fica reservado para casos com necessidade de intervenção imediata, devido àa apresentação de sintomas compatíveis com falência cardíaca, comprometimento respiratório com necessidade de ventilação mecânica permanente e comprometimento hemodinâmico.5
Entretanto, não há evidências estatisticamente significativas que indiquem a preferência pela abordagem conservadora, que consiste em restrição hídrica e observação cautelosa do fechamento espontâneo do canal arterial,19,20 ou pelo tratamento medicamentoso com inibidores da ciclooxigenase (COX), como a indometacina e o ibuprofeno,12 ou com acetaminofeno (paracetamol)8. Essas drogas, apesar de favorecerem o fechamento do canal arterial, podem provocar efeitos colaterais, como os gastrointestinais e renais associados ao uso de inibidores da COX21 e os efeitos ainda pouco estudados relacionados ao uso de paracetamol.8
Frente a essa problemática, este estudo, realizado na UTI Neonatal de um hospital de referência estadual no atendimento a recém-nascidos de alto risco, teve como objetivo avaliar a incidência de PCA em RNPTs, o perfil clínico e a evolução desses pacientes frente às diferentes opções terapêuticas adotadas. Espera-se contribuir para a definição de condutas quanto ao manejo adequado dessa cardiopatia congênita, aprimorando a qualidade da assistência médica.
METODOLOGIA
Trata-se de um estudo de coorte retrospectivo, observacional, desenvolvido no Hospital São Vicente de Paulo, situado na cidade de Passo Fundo, considerado um ponto de referência em saúde do estado do Rio Grande do Sul e que atende ao Sistema Único de Saúde (SUS) de forma paritária.
A partir dos registros da Rede Gaúcha de Neonatologia, a população foi composta por 574 RNPTs de muito baixo peso (< 1.500g), internados na Unidade de Terapia Intensiva Neonatal (UTIN) de janeiro de 2016 a dezembro de 2020. Desta população, 58 RNPTs (10,10%) foram excluídos do estudo, sendo 44 por evoluírem a óbito nas primeiras 72 horas de vida, 5 por apresentarem anomalias cromossômicas e 9 por serem portadores de malformações complexas (hipoplasia pulmonar, agenesia de valva pulmonar, tronco arterioso do tipo I, tetralogia de Fallot, dextrocardia e ventrículo esquerdo único), resultando em uma amostra final de 516 pacientes.
As variáveis estudadas podem ser classificadas como fatores neonatais e perinatais - compostos por sexo, peso e idade gestacional (IG) ao nascer, uso de corticoide antenatal e desfecho - e fatores relacionados à persistência do canal arterial (PCA), como presença ou ausência, tamanho, repercussão hemodinâmica, tratamento proposto e associação com malformações cardíacas. Cabe ressaltar que a IG foi estimada, preferencialmente, por ultrassonografia obstétrica realizada no primeiro trimestre ou data da última menstruação, sendo utilizado o método de New Ballard22 na ausência desses dados.
A variável desfecho inclui tanto o desenvolvimento de displasia broncopulmonar, caracterizada por necessidade de oxigênio com idade gestacional corrigida maior ou igual a 36 semanas, quanto a evolução ao óbito. A variável tratamento proposto para a PCA foi classificada como conservador, medicamentoso ou cirúrgico, conforme observado nos registros.
Em relação à análise estatística, foram avaliadas diferentes medidas de tendência central e de dispersão conforme as variáveis estudadas, sendo as frequências simples e relativa para as categóricas e a média e o desvio padrão para as numéricas. Para a análise das variáveis categóricas, utilizaram-se os testes Exato de Fisher e Qui-Quadrado, e para as variáveis numéricas, primeiramente realizou-se um teste de normalidade (Kolmogorov-Smirnov), seguindo-se testes paramétricos (t de Student e Análise de Variância - ANOVA One Way com post hoc de Bonferroni) se distribuição normal, ou os testes não paramétricos (U de Mann-Whitney), se distribuição não normal. O processamento e análise dos dados foram realizados pelo programa Statistical Package for the Social Sciences (SPSS) 18.0, sendo adotado um nível de significância de 5%.
O estudo obedeceu a todos os critérios éticos aplicáveis estabelecidos pelo Conselho Nacional de Saúde (CNS) através da Resolução nº466/2012, tendo sido aprovado pelo Comitê de Ética em Pesquisa (CEP) sob CAAE 26000519.2.0000.5342. Os riscos inerentes a essa pesquisa foram mínimos, uma vez que realizou0se a análise dos registros da Rede Gaúcha de Neonatologia e foram assegurados a privacidade e o anonimato das informações coletadas.
RESULTADOS
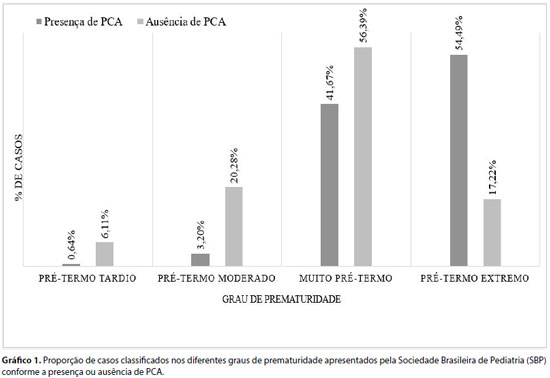
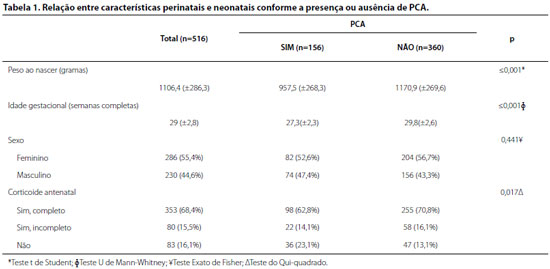
Foram avaliadas as características perinatais e neonatais referentes aos 516 RNPTs de muito baixo peso, conforme a presença ou ausência de persistência do canal arterial, sendo esta patologia identificada através de ecocardiografia em 30,23% (n=156) da amostra. Esse grupo apresentou uma menor proporção de casos de pré-termos tardios, os quais correspondem aos RNPTs com idade gestacional ao nascer entre 34 e 37 semanas, e maior proporção de casos de pré-termos extremos, com IG inferior a 28 semanas (gráfico 1), além de uma média de peso ao nascer significativamente menor, conforme apresentado na Tabela 1.
A realização de corticoide antenatal apresentou-se como um fator protetor estatisticamente significativo, independentemente da forma como foi avaliado. Ao ser analisado como uma variável dicotômica através do teste Exato de Fisher, observou-se que de 433 pacientes submetidos a essa conduta, 313 não apresentaram PCA, o que corresponde a 86,9% deste grupo, enquanto 120 (76,9%) apresentaram essa cardiopatia (p=0,006). Quando classificado em categorias, conforme apresentado na Tabela 1, observa-se que um curso completo de corticoide antenatal foi administrado em dois terços dos pacientes, sendo 255 (70,8%) pertencentes ao grupo sem PCA, enquanto 16,1% (n=58) receberam uma única dose de betametasona e 13,1% (n=47) não receberam essa medicação.
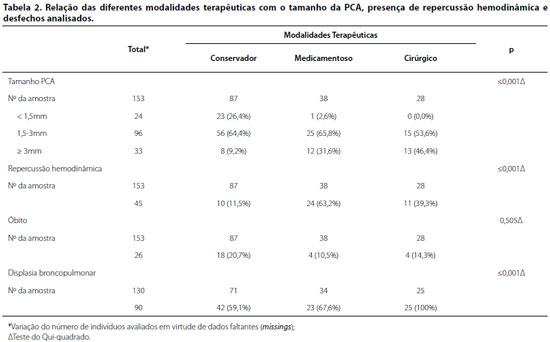
Dos 156 pacientes que apresentaram PCA, três foram desconsiderados por ausência de informações e/ou transferência para outra UTIN. Conforme o tamanho do ducto arterioso, os 153 casos restantes foram classificados em pequeno (<1,5mm), moderado (1,5-2,9mm) ou grande (≥3mm), e então avaliada a modalidade terapêutica adotada, sendo constatada relação estatisticamente significativa ao demonstrar maior número de pacientes submetidos a tratamento conservador quanto menor o tamanho do ducto arterioso (Tabela 2). Também se verificou que a média do tamanho do ducto nos pacientes submetidos a tratamento conservador foi de 1,92(±0,66)mm, valor significativamente menor (p≤0,001) se comparado às médias encontradas nos submetidos ao tratamento medicamentoso (2,64±0,57mm) e ao tratamento cirúrgico (2,99±0,66mm), separadamente, através da Análise de Variância (ANOVA) e do teste post hoc de Bonferroni.
Como a análise da apresentação clínica dos pacientes através do exame físico seria pouco fidedigna por variar conforme o profissional responsável pela avaliação, optou-se por considerar a presença ou ausência de repercussão hemodinâmica conforme descrito no laudo ecocardiográfico, e posteriormente, relacionar este fator ao tamanho da PCA e ao tratamento adotado. Identificou-se que as médias do tamanho da PCA em pacientes com e sem repercussão hemodinâmica foram, respectivamente, de 2,74(±0,50)mm e 2,10(±0,79)mm, sendo que essa diferença foi estatisticamente significativa (p≤0,001). A Tabela 2 descreve a proporção desses casos conforme o tratamento adotado, sendo maior proporção evidenciada no grupo submetido ao tratamento medicamentoso.
Quanto a evolução clínica e desfecho apresentados pelos pacientes com PCA, maior taxa de mortalidade foi evidenciada no grupo submetido ao tratamento conservador, embora o poder estatístico dessa associação tenha sido insuficiente. Ao estudar o desenvolvimento de displasia broncopulmonar, foram excluídos os RNPTs que evoluíram a óbito antes de completar 36 semanas de idade gestacional corrigida, resultando numa amostra composta por 130 pacientes diagnosticados com a cardiopatia analisada. Destes, 90 (69,23%) evoluíram com DBP; as incidências de displasia broncopulmonar nos grupos de tratamento conservador foram 42/71 (59,1%), no tratamento medicamentoso 23/43 (67,9%) e no tratamento cirúrgico de 25/25 (100%).
DISCUSSÃO
Ao avaliar 516 RNPTs com muito baixo peso, o atual estudo evidenciou uma taxa de persistência do canal arterial de 30,23%, sendo as médias do peso e da idade gestacional ao nascer deste grupo de 957,5g e 27,3 semanas. Apesar da diferença em relação a valores encontrados na literatura, que apresentaram incidências de 61,3% (73/119), com um aumento para 75% (30/40) quando avaliados somente os RNPTs com peso inferior a 1000g,23 a faixa de normalidade compreende os valores entre 20 e 60% conforme os critérios diagnósticos adotados, com um aumento quanto menor o peso e a IG ao nascer. Estudos como de Huang et al.,9 realizado em Taiwan, ao avaliar os pacientes RNPT com essa cardiopatia, apresentou média de peso e IG ao nascimento de 1058g e 28,3 semanas.
Dentre as informações presentes nos prontuários que poderiam justificar menor incidência de PCA no atual estudo, encontrou-se um valor estatisticamente significativo associado a realização de corticosteroide antenatal, sendo a betametasona a medicação padrão. Essa relação e/ou a associação com uma apresentação clinicamente significativa desta patologia, também pode ser evidenciada em estudos presentes na literatura.6,9
Ao realizar a análise ecocardiográfica do tamanho do ducto arterioso patente nos 153 pacientes diagnosticados com esta cardiopatia, encontrou-se um tamanho médio de 2,29(±0,78)mm; entretanto, maiores médias foram observadas ao analisar separadamente os pacientes que apresentaram repercussão hemodinâmica (2,74mm). Valores inferiores foram encontrados por Locali et al.,24 com tamanho médio apresentado de 1,96mm. Nos estudos de McNamara et al.25 e Arlettaz,26 é proposto um sistema de estadiamento para avaliação dos canais arteriais conforme o tamanho apresentado, classificando em pequeno, se inferior a 1,5mm, moderado se entre 1,5 e 3mm e grande se maior que 3mm. Foi constatada uma sensibilidade de 81% e uma especificidade de 85% para diâmetros acima de 1,5 mm visando à detecção de casos desta cardiopatia com repercussão hemodinâmica.
Como a PCA é a cardiopatia mais comum em neonatos,27 e atualmente não existe consenso quanto ao tratamento que confere melhor prognóstico aos recém-nascidos, diversos estudos, em âmbito mundial, estão sendo realizados com o objetivo de encontrar a abordagem terapêutica ideal, visando um melhor equilíbrio dos riscos e benefícios. Muitos neonatologistas defendem uma abordagem mais conservadora, ressaltando que primeiramente deve-se reconhecer os pacientes que precisam ser submetidos ao fechamento do canal arterial, visto que os procedimentos terapêuticos atuais não são isentos de riscos e não evidenciaram redução significativa da morbimortalidade associada a patência desta estrutura.28,29 Entretanto, divergências na literatura podem ser observadas quanto ao aumento da mortalidade e da apresentação de complicações maiores da prematuridade associadas à ligadura cirúrgica do ducto arterioso, como a displasia broncopulmonar.
Apesar de não demonstrar associação significativa em relação ao número de óbitos, o presente estudo evidenciou uma proporção significativamente maior de casos de DBP nos pacientes submetidos ao tratamento medicamentoso e/ou cirúrgico, resultado semelhante ao observado por Chorne et al.6 Contudo, deve-se ressaltar que os pacientes submetidos a essas abordagens terapêuticas apresentam quadros mais graves desta cardiopatia, sendo associados a tamanhos médios maiores de PCA e maior número de pacientes com repercussão hemodinâmica (p≤0,001).
Uma nova alternativa à cirurgia é o fechamento percutâneo do canal arterial por cateterismo cardíaco, que tem se apresentado como uma opção terapêutica precoce em prematuros de muito baixo peso. Todavia, mais estudos são necessários para a definição da indicação, do momento de realização dessa intervenção e das complicações relacionadas a ela, não havendo dados específicos relacionados ao desenvolvimento de DBP.30
CONCLUSÃO
Ao estudar os RNPTs de muito baixo peso, pertencentes a UTIN de um hospital considerado referência estadual, quanto a presença ou ausência de PCA, observou-se uma relação inversamente proporcional entre as características neonatais, como o peso e a IG ao nascer, e a apresentação desta patologia.
Quanto à profilaxia e ao manejo terapêutico da patência do ducto arterioso, o presente estudo demonstrou que o uso de corticoide antenatal é um fator protetor ao desenvolvimento desta cardiopatia, e que se optou preferencialmente pelo tratamento conservador, sendo os tratamentos medicamentosos e cirúrgicos priorizados nos casos que apresentaram repercussão hemodinâmica e/ou ductos de maiores diâmetros. Tais características são possíveis fatores de confusão frente à maior apresentação de DBP nos pacientes submetidos a ligadura cirúrgica. Todavia, como não há consenso entre os especialistas, mais estudos são necessários para definir a abordagem terapêutica ideal, visando a um melhor equilíbrio dos riscos e benefícios.
REFERÊNCIAS
1. Mattos SS. Fisiologia da circulação fetal e diagnóstico das alterações funcionais do coração do feto. Arq Bras Cardiol. 1997;69(3):205-207
2. Dice JE, Bhatia J. Patent ductus arteriosus: an overview. J Pediatr Pharmacol Ther. 2007;12(3):138-46.
3. Benson LN. The arterial duct: its persistence and its patency. 3ed. New York In: Paediatric Cardiology. Philadelphia: Elsevier Saunders; 2010. 875-93p.
4. Johnson Jr WH, Moller MD, James H. Classification and physiology of congenital heart disease in children. 3ed Pediatr Cardiol. 2014;(1):86-94.
5. Gillam-Krakauer M, Reese J. Diagnosis and management of patent ductus arteriosus. Neoreviews. 2018;19(7):394-402
6. Chorne N, Jegatheesan P, Lin E, Shi R, Clyman RI. Risk factors for persistent ductus arteriosus patency during indomethacin treatment. J Pediatr. 2007;151(6):629-34.
7. Clyman RI, Couto J, Murphy GM. Patent ductus arteriosus: are current neonatal treatment options better or worse than no treatment at all? Semin Perinatol. 2012;36(2):123-9.
8. Heuchan AM, Clyman RI. Managing the patent ductus arteriosus: current treatment options. Arch Dis Child Fetal Neonatal Ed. 2014;99(5):F431-6.
9. Huang HW, Lin C, Hsu KH, Hsu SY, Mok TY, Wu IH, et al. Protective factors against preterm infants to develop significant patent ductus arteriosus. Pediatrics & Neonatology. 2021;62(4):379-86.
10. Santos J, Soares P, Ferreras C, Flor-de-Lima F, Guimarães H. Patência do canal arterial no recém-nascido de pré-termo: experiência de um hospital terciário. Revista Portuguesa de Cardiologia. 2021.
11. Lima MRO, Andrade MA, Araújo APG, Figueroa JN, Andrade LB. Influência de fatores maternos e neonatais no desenvolvimento da displasia broncopulmonar. Rev Assoc Med Bras. 2011;57(4):398-403.
12. Mirea L, Sankaran K, Seshia M, Ohlsson A, Allen AC, Aziz K, et al. Treatment of patent ductus arteriosus and neonatal mortality/morbidities: adjustment for treatment selection bias. J Pediatr. 2012;161(4)689-94.
13. Gillam-Krakauer M, Hagadorn JI, Reese J. Pharmacological closure of the patent ductus arteriosus: when treatment still makes sense. J Perinatol. 2019;39(11):1439-41.
14. Mandhan PL, Samarakkody U, Brown S, Kukkady A, Maoate K, Blakelock R, et al. Comparison of suture ligation and clip application for the treatment of patent ductus arteriosus in preterm neonates. J Thorac Cardiovasc Surg. 2006;132(3):672-4.
15. Clement WA, El-Hakim H, Phillipos EZ, Coté JJ. Unilateral vocal cord paralysis following patent ductus arteriosus ligation in extremely low-birth-weight infants. Arch Otolaryngol Neck Surg. 2008;134(1):28-33.
16. Hsu KH, Chiang MC, Lien R, Chu JJ, Chang YS, Chu SM, et al. Diaphragmatic paralysis among very low birth weight infants following ligation for patent ductus arteriosus. Eur J Pediatr. 2012;171(11):1639-44.
17. Sehgal A, Francis JV, James A, McNamara PJ. Patent ductus arteriosus ligation and post-operative hemodynamic instability: case report and framework for enhanced neonatal care. Indian J Pediatr. 2010;77(8):905-7.
18. Clyman R, Cassady G, Kirklin JK, Collins M, Philips III JB. The role of patent ductus arteriosus ligation in bronchopulmonary dysplasia: reexamining a randomized controlled trial. J Pediatr. 2009;154(6):873-6.
19. Semberova J, Sirc J, Miletin J, Kucera J, Berka I, Sebkova S, et al. Spontaneous closure of patent ductus arteriosus in infants ≤ 1500 g. Pediatrics. 2017;140(2):1-8.
20. Benitz WE. Hey, Doctor, Leave the PDA alone. Pediatrics. 2017;140(2):1-2.
21. Sankar MN, Bhombal S, Benitz WE. PDA: To treat or not to treat. Congenit Heart Dis. 2019;14(1):46-51.
22. Ballard JL, Khoury JC, Wedig K, Wang L, Eilers-Walsman BL, Lipp R. New Ballard score, expanded to include extremely premature infants. J Pediatr. 1991;119(3):417-23.
23. Visconti LF, Morhy SS, Deursch AD, Tavares GM, Wilberg TJ, Rossi FS. Características clínicas e ecocardiográficas associadas à evolução do canal arterial em recém-nascidos com peso de nascimento inferior a 1.500g. Einstein (São Paulo). 2013; 11(3):317-23.
24. Locali RF, Matsuoka PK, Gabriel EA, Júnior AB, Rotta CAL, Catani R, et al. Tratamento da persistência de canal arterial em recém-nascidos prematuros: análise clínica e cirúrgica. Arq Bras Cardiol. 2008;90(5): 345-9.
25. McNamara PJ, Sehgal A. Towards rational management of the patent ductus arteriosus: the need for disease staging. Arch Dis Child Fetal Neonatal Ed. 2007; 92(6):F424-7.
26. Arlettaz R. Echocardiographic evaluation of patent ductus arteriosus in preterm infants. Front Pediatr. 2017;5:147.
27. Mitchell SC, Korones SB, Berendes HW. Congenital heart disease in 56,109 births: incidence and natural history. Circulation. 1971;43(3):323-32.
28. Okulu E, Erdeve O, Arslan Z, Demirel N, Kaya H, Kursad I, et al. An observational, prospective, multicenter, registry-based cohort study comparing conservative and medical management for patent ductus arteriosus. Front Pediatr. 2020; 8:434.
29. Clyman RI, Liebowitz M, Kaempf J, Erdeve O, Bulbul A, Håkansson S, et al. PDA-TOLERATE trial: an exploratory randomized controlled trial of treatment of moderate-to-large patent ductus arteriosus at 1 week of age. J Pediatr. 2019; 205(6):41-8.
30. Morville P, Douchin S, Bouvaist H, Dauphin C. Transcatheter occlusion of the patent ductus arteriosus in premature infants weighing less than 1200g. Arch Dis Child Fetal Neonatal. 2018;103(3):198-201.