Número atual: 22(1) - Março 2022
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Relato de Caso
Manifestações clínicas e lesões isquêmicas da chikungunya neonatal em unidade neonatal do interior do Estado do Rio de Janeiro: relato de dois casos
Clinical manifestations and ischemic lesions of neonatal chikungunya in a neonatal unit in the state of Rio de Janeiro: Report of two cases
Charbell Miguel Haddad Kury1,2,3; Barbara Soares de Oliveira Souza1,3; Edwarda Ciâncio Soares-Silva1,2; Dayana Brasileiro Haddad Parente1,4; Esther de Souza Beira1,2; João Pedro Silva Castro-Cardoso1,2; Juliana dos Santos Valentim da-Silva1,2; Leonardo Pereira Barros1; Bruno Passebom Soares5; Leonardo Vandesteen6
DOI:10.31365/issn.2595-1769.v22i1p35-40
1. Hospital São João Batista de Macaé, UTI neonatal Leandro Soares - Macaé - RJ - Brasil.
2. Faculdade de Medicina de Campos, Pediatria - Internato - Campos dos Goytacazes - Rio de Janeiro - Brasil.
3. Universidade Federal do Rio de Janeiro - Campus Macaé, Pediatria - Internato - Macaé - Rio de Janeiro - Brasil.
4. Universidade Estácio de Sá, Pediatria - Internato - Rio de Janeiro - Rio de Janeiro - Brasil.
5. Larner College of Medicine at The University of Vermont, Neuroradiology - Burlington - Vermont - Estados Unidos.
6. Faculdade de Medicina de Campos, Radiologia - Campos dos Goytacazes - Rio de Janeiro - Brasil
Endereço para correspondência:
Recebido em: 25/08/2020
Aprovado em: 08/10/2021
Instituição: Hospital São João Batista de Macaé, UTI neonatal Leandro Soares - Macaé - RJ - Brasil
Resumo
INTRODUÇÃO: O vírus Chikungunya (CHIKV) é causador de quadros infecciosos agudos. O primeiro caso de transmissão vertical foi identificado em 2005. Atualmente, essa infecção viral representa um grave risco para os neonatos de mães sintomáticas.
OBJETIVO: Descrever manifestações clínicas e radiológicas em dois casos de chikungunya neonatal por transmissão vertical.
DESCRIÇÃO DO CASO: Neonatos filhos de mães que apresentaram ao final da gestação quadro de infecção por CHIKV confirmada laboratorialmente. Caso 1: neonato, masculino, iniciou quadro de cianose perioral, evoluindo no 6º dia com choro e irritabilidade. Realizada ressonância magnética de crânio (RNM), que evidenciou encefalite aguda com lesão parenquimatosa e áreas de necrose/liquefação periventricular e extensão para os membros posteriores das cápsulas internas. Houve evolução para sepse neonatal precoce. Caso 2: neonato feminino, iniciou no 4º dia de vida quadro de irritabilidade, febre e exantema maculopapular em região de dorso. A doença evoluiu para enterocolite necrotizante cirúrgica. A RNM também evidenciou sinais de encefalite aguda por CHIKV. Ambos os casos obtiveram sorologia IgM positiva para CHIKV. Ambos foram submetidos a tratamento antimicrobiano associado a terapia com imunoglobulina humana e suporte sintomático. Após melhora clínica, receberam alta hospitalar, respectivamente, no 25º e 47º dia de vida.
DISCUSSÃO: A encefalite por CHIKV é uma manifestação neurológica grave, com implicações em neurodesenvolvimento. A abordagem propedêutica desta doença deve envolver todo um conjunto de suporte clínico e análise por exames de imagem, sendo imperativo avaliar o neurodesenvolvimento cerebral, pois este norteia as tomadas de decisões terapêuticas/suporte, a fim de se evitarem sequelas no longo prazo. O uso de imunoglobulina humana em ambos os casos foi seguro e protetor.
Palavras-chave: Vírus Chikungunya. Encefalite Viral. Imunoglobulinas.
Abstract
INTRODUCTION: The Chikungunya virus (Chikv) causes serious infectious conditions. The first vertical transmission case was identified in 2005. Currently, this viral infection represents a serious risk for the neonates of symptomatic mothers.
OBJECTIVE: To describe clinical and radiological manifestations in two cases of neonatal chikungunya by vertical transmission.
CASE DESCRIPTION: Neonates children of mothers who presented at the end of pregnancy chikv infection confirmed in laboratory. Case 1: Male newborn presented perioral cyanosis, evolving on the 6th day with crying and irritability. Performed magnetic resonance of skull (MRI), which showed acute encephalitis with parenchymal lesion and areas of necrosis / periventricular liquefaction and extension for subsequent members of internal capsules. There was evolution for early neonatal sepsis. Case 2: Female newborn began on the 4th day of life irritability, fever and maculopapular fever in the back region. The disease has evolved to surgical necrotizing enterocolitis. MRI has also evidenced signs of acute encephalitis by Chikv. Both cases presented positive IgM serology for Chikv. Both were submitted to antimicrobial treatment associated with human immunoglobulin therapy and symptomatic support. After clinical improvement, they received hospital discharge, respectively, on the 25th and 47th day of life.
DISCUSSION: Chikv encephalitis is a serious neurological manifestation, with implications of neurodevelopment. The propaedeutical approach of this disease should involve a whole set of clinical support and analysis by imaging examinations, and it is imperative to evaluate brain neurodevelopment, since this guides the therapeutic decision / support sockets in order to avoid sequels in the long run. The use of human immunoglobulin in both cases was safe and protective.
Keywords: Chikungunya virus. Encephalitis. Immunoglobulins, Intravenous.
INTRODUÇÃO
O vírus Chikungunya (CHIKV) é um alfavírus da família Togaviridae, identificado pela primeira vez em 1952 na região da Tanzânia. Grandes epidemias de CHIKV apareceram e desapareceram ciclicamente com um período interepidêmico que variam de 7 a 20 anos. Nesse período, o vírus se espalhou do Quênia pelas regiões do Oceano Índico, Oceano Pacífico e Caribe. Desde então, o CHIKV tem sido responsável por surtos. A epidemia mais bem estudada ocorreu na Ilha de Reunião, no Oceano Índico, durante 2005. Foram identificados casos de transmissão fetal materna durante esses surtos, mas poucos estudos avaliaram sistematicamente os resultados clínicos neonatais da infecção na América Latina.1
O primeiro surto de CHIKV no Brasil foi relatado em 2013-2014, com 37 pacientes originários principalmente do Haiti e da República Dominicana. De janeiro de 2016 a julho de 2021, 733.703 casos de CHIKV foram registrados no Brasil.2-4
A CHIKV é transmitida ao homem pela picada de mosquitos dos gêneros Aedes aegypti e Aedes albopictus e pela transmissão vertical no período perinatal, com valores próximos a 50%. O período de incubação dura de três a sete dias e pode durar até meses. Não foi relatada influência do tipo de parto (vaginal ou cesariana) na transmissibilidade.5,6
A doença afeta mulheres grávidas de maneira semelhante a qualquer outro adulto. As manifestações clínicas são inespecíficas, variando de sintomas gerais como febre, mialgias, artralgia e erupção cutânea a manifestações oftalmológicas, neurológicas e cardíacas graves.7,8 No entanto, ao contrário do Zika, a infecção materna por CHIKV próxima ao nascimento da criança está associada a um maior número de complicações fetais e neonatais graves.8
Atualmente, a doença representa um grande risco para os recém-nascidos de mães sintomáticas. Os neonatos infectados geralmente desenvolvem sintomas durante a primeira semana de vida.3 Nesses pacientes, o espectro da infecção inclui dor, febre, letargia, edema generalizado, irritabilidade e lesões na pele. Além disso, anomalias hematológicas como trombocitopenia, linfopenia e hipoprotrombinemia também foram descritas.9 Acredita-se que cerca de 40% dos pacientes evoluem para formas graves da doença, com disfunção hepática, cardiovascular, pulmonar e neurológica.7
Este artigo tem como objetivo de relatar dois casos de CHIKV neonatal com evidências clínicas e radiológicas de encefalite por este vírus, tendo ambos recebido uma abordagem terapêutica com o uso de imunoglobulina endovenosa humana.
DESCRIÇÃO DOS CASOS
Caso 1
MCMN, 34 anos, primigesta, realizou pré-natal adequado, incluindo ultrassom morfológico e outros exames de rotina. Na 37ª semana de gestação, apresentou erupção maculopapular generalizada, poliartralgia e febre, e foi submetida a cesariana. A paciente deu à luz um recém-nascido masculino a termo, peso 3.805 g, Apgar 7 e 8. As sorologias maternas para toxoplasmose, citomegalovírus, sífilis, HIV, hepatite B e C foram negativas.
No quarto dia de vida (2 dias após a alta hospitalar), o neonato evoluiu com cianose perioral, recusa em alimentar-se e perda excessiva de peso, sendo encaminhado para a Unidade de Terapia Intensiva Neonatal (UTIN) do Hospital.
Devido à condição clínica materna e registros epidêmicos na região, suspeitava-se de CHIKV neonatal. As sorologias maternas e neonatais foram coletadas e apresentaram IgM positiva para CHIKV. No mesmo dia, o recém-nascido evoluiu com aumento da pigmentação da face, febre, irritabilidade e choro. Foi iniciado tratamento com antipirético e prednisolona (2mg / kg / dia).
No 6º dia de vida, o recém-nascido apresentou piora do choro, irritabilidade e redução do reflexo de sucção, o que levantou a hipótese diagnóstica de encefalite viral. Foi realizada punção lombar para análise do LCR, com concentração total de proteínas de 145,0 mg / dL e glicose de 32 mg / dL (valores de referência para bebês a termo10: proteínas 64,2mg/dL +/- 24,2 (desvio padrão) / glicose 51,2mg/dL +/- 12,9 (desvio padrão). O tratamento com imunoglobulina IV foi iniciado (1g / kg / dia - 2 dias). No 7º dia de vida, surgiram lesões eritematosas difusas no palato e na gengiva, com áreas de sangramento, além de lesões escamosas com aparência foliácea por toda a pele, incluindo mãos, pés e região genital.
Os exames laboratoriais realizados no 11º dia de vida indicaram leucócitos totais de 28.430/mm³ com desvio para a esquerda e trombocitopenia de 97.000/mm³. Iniciada terapia medicamentosa com aciclovir, cefepima e fluconazol. A avaliação oftalmológica mostrou hiperemia e papiledema.
Ao 12º dia de vida, o recém-nascido apresentou edema bilateral nos membros inferiores. No 17º dia de vida, houve piora clínica e laboratorial, com leucócitos totais atingindo um valor de 34.560/mm³ com desvio à esquerda, além de hemocultura mostrando crescimento de Klebsiella pneumoniae resistente ao cefepime. O tratamento com cefepime foi interrompido e um regime de meropenem foi iniciado.
A ressonância magnética (RM) mostrou anormalidade do sinal hiperintenso T2 e difusão restrita simetricamente envolvendo o corpo caloso e substância branca dos hemisférios cerebrais, consistente com lesão parenquimatosa aguda com áreas de necrose /liquefação periventricular e extensão para os membros posteriores das cápsulas internas, compatível com o diagnóstico de encefalite viral (Figuras 1 e 2). O eletroencefalograma (EEG) foi normal para a faixa etária. Após antibioticoterapia, observou-se melhora clínica, embora a hipotonia fosse mantida e melhora laboratorial com leucócitos totais atingindo 10.600 / mm³ no 23º dia de vida. O recém-nascido recebeu alta após 25 dias.
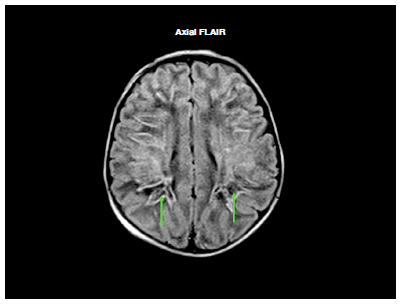
Figura 1. Ressonância magnética de crânio.
Áreas de liquefação da substância branca dos hemisférios cerebrais em hipossinal FLAIR.
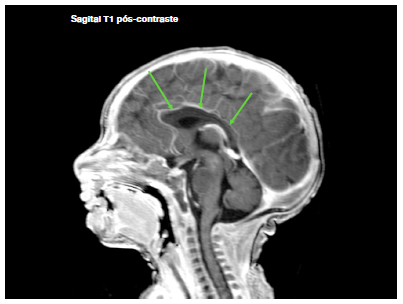
Figura 2. Ressonância magnética de crânio
Hipossinal T1 difuso do corpo caloso (setas), sem realce pelo meio de contraste e com restrição à difusão passiva das moléculas de água, compatível com edema citotóxico e necrose / liquefação periventricular e extensão para os membros inferiores das cápsula internas.
Caso 2
C.A., 30 anos, terceira gestação com 39 semanas de idade gestacional. Antecedente materno de infecção urinária tratada com amoxicilina com clavulanato no último trimestre. Além disso, cerca de quatro dias antes do parto, a mãe relatou quadro de erupção maculopapular generalizada, poliartralgia e febre. Sorologias maternas para toxoplasmose, citomegalovírus, sífilis, HIV, hepatite B e C negativas.
Neonato do sexo feminino, nascida a termo de parto cesáreo no hospital público da cidade devido a bradicardia fetal, peso 3.115g, estatura 49 cm, perímetro cefálico 35 cm e Apgar 9 e 10. Com boa recuperação no pós-parto foi encaminhada ao alojamento conjunto.
No 4º dia de vida, o neonato apresentou irritabilidade, febre e exantema maculopapular em dorso e abdome. Iniciado tratamento com dipirona regular. Devido ao quadro clínico materno associado à história epidemiológica, suspeitou-se de CHIKV neonatal.
Posteriormente, foram colhidas sorologias materna e do neonato, cujos resultados IgM positivos para a doença foram encontrados. Após tratamento inicial, o neonato foi encaminhado o serviço de UTIN, onde, além de dipirona regular, foi iniciado esquema antibiótico com ampicilina e amicacina. Exames laboratoriais realizados no 9º dia de vida indicaram plaquetopenia de 47.000/mm³, sendo realizado concentrado de plaquetas.
Devido à estabilidade clínica, o neonato no 11º dia de vida retornou para unidade de cuidados intermediários do mesmo hospital público. No mesmo dia, a criança mostrou-se hipotônica, irritada e com regurgitação de secreção com aspecto esverdeado. Ao exame, o abdome estava distendido, com hepatomegalia e sem peristalse. Apresentava também descamação difusa nos membros e lesões vesiculares e bolhosas na face, sendo a antibioticoterapia anterior substituída por piperacilina/tazobactam e encaminhado para o serviço de UTIN.
Após evidenciar leucocitose e grande volume de líquido livre em cavidade abdominal, além de alterações na radiografia de abdome, o neonato foi submetido a uma drenagem percutânea. No 13º dia de vida, foi encaminhado ao centro cirúrgico para resolução do quadro de enterocolite necrosante (ECN). O tratamento cirúrgico se deu através de enterectomia com retirada do cólon ascendente e ceco (figura 3). A cultura do líquido ascítico foi positiva para Klebisiella pneumoniae e o esquema antibiótico substituído por meropenem associado a vancomicina. Realizada punção lombar para análise do líquor, evidenciando-se proteinorraquia total de 92,0 mg/dL. Iniciou-se tratamento com imunoglobulina humana IV.
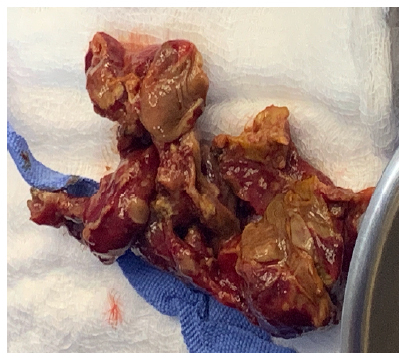
Figura 3. Enterectomia com retirada de colon ascendente e ceco + colostomia a D
Enterocolite necrotizante cirúrgica pós Chikungunya
Exames laboratoriais realizados no 23º dia de vida indicaram leucócitos totais de 23.780/mm³ com desvio à esquerda. Iniciou-se terapia medicamentosa com aciclovir e fluconazol, além da substituição do esquema antibiótico por levofloxacino associado a metronidazol.
A ressonância nuclear magnética (RNM) demonstrou alteração de sinal comprometendo o corpo caloso, os braços anteriores das cápsulas internas e a substância branca das regiões fronto-parietais, compatível com a encefalite viral. Paciente apresentou relevante melhora clínica e laboratorial com leucócitos totais no valor de 8.100/mm³, recebendo alta hospitalar no 47º dia de vida.
DISCUSSÃO
A chegada da CHIKV ao Brasil em 2013 trouxe consigo o peso das epidemias desta arbovirose em termos da maior notificação da doença neurológica a ela associada. Este estudo descreve dois casos de infecção congênita por CHIKV como agente etiológico com o desfecho neurológico de encefalite viral.
Quando consideramos o período da gravidez em que houve a transmissão, nosso relato demonstrou que em ambos os casos o determinante da transmissão foi o momento da gravidez em que as mães estavam com a doença aguda, respectivamente, com 24 horas e 96 horas antes do parto. Este relato possui semelhança com diversos estudos sobre a dinâmica de transmissão por CHIKV com elevada transmissão congênita quando da infecção materna no período periparto, em comparação com estágios precoces da gravidez. Um estudo colombiano avaliou uma série de casos de chikungunya neonatal em que os 8 bebês do estudo foram internados em UTI neonatal com quadro de meningoencefalite por infecção adquirida no período periparto.11 Entretanto, em outro artigo com 739 gestantes com quadro de CHIKV, 700 delas não apresentaram doença aguda no período intraparto e os bebês de todas nasceram sem sintomas clínicos.12
Outro aspecto relacionado ao relato caracterizou-se pelos achados clínicos de ambos os casos do presente estudo. Sabe-se que, em bebês infectados, os sintomas de CHIKV geralmente aparecem entre o terceiro e o sétimo dia de vida.6,13 Apesar de que em 3 a 47% dos casos a infecção por CHIKV podem ser assintomáticos, os sintomas neurológicos e seu impacto em longo prazo no neurodesenvolvimento têm sido alvo de diversos trabalhos desde a eclosão de grave epidemia na Ilha de Reunião, território pertencente à França. Em um deles, com 739 gestantes que tiveram CHIKV, 39 apresentaram doença no período periparto, e destes a grande maioria (19 pacientes) apresentou-se assintomática ao nascer. Entretanto, no período de 3 a 7 dias desenvolveram sintomas, dos quais 9 com sinais de encefalopatia.12
Com menos frequência, o CHIKV pode ser uma causa da síndrome de Guillain-Barré, hipotonia neonatal e doenças neuro-oculares, como retinite, uveíte e neurite óptica. Além das manifestações neurológicas, o vírus também pode levar, mais raramente, a complicações cardiovasculares, renais, respiratórias, gastrointestinais e suprarrenais, conhecidas como características atípicas.7,14 A presença de papiledema no fundo de olho do primeiro caso esteve diretamente relacionada à gravidade neurológica e à necessidade de darmos importância ao exame de fundo de olho na situação de suspeita de doença congênita e de implicação neurológica.
Em relação aos achados laboratoriais, em ambos os casos houve plaquetopenia. Os estudos confirmam a teoria de que o achado laboratorial mais comum nas infecções neonatais relacionadas ao CHIKV por transmissão vertical é trombocitopenia, que está associada ao maior tempo de protrombina e coagulação intravascular disseminada, resultando em episódios de sangramento.5,13,15,16 O diagnóstico da infecção por CHIKV pode ser estabelecido usando RT-PCR ou sorologia específica para CHIKV.13
O comprometimento neurológico resultante da infecção pelo CHIKV geralmente apresenta envolvimento cerebral multifocal, afetando estruturas como lobos temporais, córtices insulares, gânglios da base e substância branca periventricular. As anormalidades descritas na tomografia computadorizada incluem edema ou hemorragia inespecífica da substância branca e sinal de recuperação de inversão atenuada T2 +/- ou sinal de difusão restrito em várias áreas do cérebro na RM.17-19 Em ambos os casos relatados em nosso trabalho, as lesões cerebrais encontradas foram reportadas previamente pela literatura e houve evolução clínica para encefalite.
No entanto, como limitação do presente relato, não acompanhamos no período pós-alta os comemorativos clínicos de evolução neurológica e de status cognitivo e motor dos casos, diferentemente do estudo de Maria et al., que tratou do relato de 13 bebês com CHIKV neonatal.20 Neste trabalho, em que os bebês tiveram alta e foram acessados para o desenvolvimento neurocognitivo, os achados após 3 meses demonstraram perda de marcos do desenvolvimento com atraso em 4 bebês; e desenvolvimento normal em 7 bebês, sendo que 2 perderam o seguimento posteriormente.
Vale ressaltar que em diversos relatos anteriores de infecção neonatal por CHIKV, a sepse grave também foi observada.3,4,7 Assim, além da imaturidade imunológica inerente aos neonatos, em que há um defeito funcional dos anticorpos, possivelmente devido a mecanismos que ainda não possuem elucidação, o patógeno predispõe a hipogamaglobulinemia secundária, causando infecções oportunistas.21 Muito provavelmente, esse mecanismo foi o mesmo fato gerador que permitiu que os pacientes aqui relatados apresentassem características clínicas tão severas de infecção viral, complicando-se com sepse neonatal precoce e enterocolite necrotizante, respectivamente.
Como agentes antivirais específicos e/ou vacinas contra o CHIKV ainda não foram desenvolvidos in vivo e considerando-se um mau prognóstico de recém-nascidos com altas taxas de morbimortalidade nos casos de encefalite viral, a imunoglobulina surge como um adjuvante terapêutico, devido a suas indicações em neonatologia em outras doenças virais e à resposta bem-sucedida obtida no presente relato.5,21,22 Outros estudos com desfechos clínicos não apenas sistêmicos, mas também devido à encefalite por Chikungunya, mostraram evidências bem-sucedidas da administração de imunoglobulina humana.23,24
A encefalite por CHIKV é uma manifestação pouco comum e frequentemente grave em neonatos infectados. O pediatra, em especial o neonatologista, deve estar atento ao diagnóstico preciso e acurado desta condição, para imediata instalação do tratamento. A imunoglobulina humana é uma possibilidade terapêutica adjunta devido à sua ampla indicação na imunodeficiência primária e secundária, com ênfase em sua importância profilática nas infecções virais congênitas. O presente relato descreve os resultados bem-sucedidos do uso de imunoglobulina humana em dois casos graves, na tentativa de limitar a letalidade dos casos de encefalite por CHIKV em neonatos.
REFERÊNCIAS
1. Contopoulos-Ioannidis D, Newman-Lindsay S, Chow C, LaBeaud AD. Mother-to-child transmission of Chikungunya virus: A systematic review and meta-analysis. PLoS Negl Trop Dis. 2018 Jun 13;12(6):e0006510. doi: 10.1371/journal.pntd.0006510. PMID: 29897898; PMCID: PMC6075784.
2. Brasil. Ministério da Saúde. Secretaria do Ministério da Saúde. Boletim Epidemiológico: Vigilância em Saúde no Brasil, 2003-2019. Número Especial. https://antigo.saude.gov.br/images/pdf/2019/dezembro/05/Boletim-Epidemiologico-Especial-SVS-16-anos-web.pdf Acesso em 06 de agosto de 2021.
3. Brasil. Ministério da Saúde. Secretaria do Ministério da Saúde. Boletim Epidemiológico nº 28. Monitoramento dos casos de arboviroses urbanas transmitidas pelo Aedes Aegypti (dengue, chikungunya e Zika até a Semana Epidemiológica 29 de 2020. https://www.gov.br/saude/pt-br/media/pdf/2021/agosto/02/boletim_epidemiologico_svs_28.pdf Acesso em 06 de Agosto de 2021.
4. Brasil. Ministério da Saúde. Secretaria do Ministério da Saúde. Boletim Epidemiológico nº 51. Monitoramento dos casos de arboviroses urbanas transmitidas pelo Aedes Aegypti (dengue, chikungunya e Zika até a Semana Epidemiológica 50 de 2020. https://www.gov.br/saude/pt-br/assuntos/media/pdf/2020/dezembro/28/boletim_epidemiologico_svs_51.pdf Acesso em 06 de junho de 2020.
5. Evans-Gilbert T. Chikungunya and Neonatal Immunity: Fatal Vertically Transmitted Chikungunya Infection. Am J Trop Med Hyg. 2017 Apr;96(4):913-915. doi: 10.4269/ajtmh.16-0491. Epub 2017 Feb 6. PMID: 28167590; PMCID: PMC5392641.
6. Oliveira RMAB, Barreto FKA, Maia AMPC, Gomes IP, Simião AR, Barbosa RB, Rodrigues ASR, Lopes KW, Araújo FMC, do Vale RLS, Cavalcante JW, Cavalcanti LPG. Maternal and infant death after probable vertical transmission of chikungunya virus in Brazil - case report. BMC Infect Dis. 2018 Jul 16;18(1):333. doi: 10.1186/s12879-018-3243-1. PMID: 30012112; PMCID: PMC6048842.
7. Cardona-Correa SE, Castaño-Jaramillo LM, Quevedo-Vélez A. Reporte de caso de transmisión vertical de la infección por virus chikungunya [Vertical transmission of chikungunya virus infection. Case Report]. Rev Chil Pediatr. 2017 Apr;88(2):285-288. Spanish. doi: 10.4067/S0370-41062017000200015. PMID: 28542664.
8. Ganesan VK, Duan B, Reid SP. Chikungunya Virus: Pathophysiology, Mechanism, and Modeling. Viruses. 2017 Dec 1;9(12):368. doi: 10.3390/v9120368. PMID: 29194359; PMCID: PMC5744143.
9. Lyra PP, Campos GS, Bandeira ID, Sardi SI, Costa LF, Santos FR, Ribeiro CA, Jardim AM, Santiago AC, de Oliveira PM, Moreira LM. Congenital Chikungunya Virus Infection after an Outbreak in Salvador, Bahia, Brazil. AJP Rep. 2016 Jul;6(3):e299-300. doi: 10.1055/s-0036-1587323. Erratum in: AJP Rep. 2016 Jul;6(3):e324. PMID: 27555980; PMCID: PMC4993616.
10. Costa KN. Meningite Neonatal. In: Sociedade Brasileira de Pediatria. Procianoy RS, Leone CR, Organizadores. PRORN Programa de atualização em Neonatologia: ciclo 16. Porto Alegre: Artmed Panamericana; 2019, p. 137-60 (Sistema de educação continuada a distância)
11. Villamil-Gomez W, Alba-Silvera L, Menco-Ramos A, et al. Congenital chikungunya virus infection in Sincelejo, Colombia: a case series. J Trop Pediatr. 2015;61(5):386-392.
12. Gerardin P, Barau G, Michault A, et al. Multidisciplinary prospective study of mother-to-child chikungunya virus infections on the island of La Reunion. PLoS Med. 2008;5(3):e60.
13. Gérardin P, Sampériz S, Ramful D, Boumahni B, Bintner M, Alessandri JL, Carbonnier M, Tiran-Rajaoefera I, Beullier G, Boya I, Noormahomed T, Okoï J, Rollot O, Cotte L, Jaffar-Bandjee MC, Michault A, Favier F, Kaminski M, Fourmaintraux A, Fritel X. Neurocognitive outcome of children exposed to perinatal mother-to-child Chikungunya virus infection: the CHIMERE cohort study on Reunion Island. PLoS Negl Trop Dis. 2014 Jul 17;8(7):e2996. doi: 10.1371/journal.pntd.0002996. PMID: 25033077; PMCID: PMC4102444.
14. Mehta R, Gerardin P, de Brito CAA, Soares CN, Ferreira MLB, Solomon T. The neurological complications of chikungunya virus: A systematic review. Rev Med Virol. 2018 May;28(3):e1978. doi: 10.1002/rmv.1978. Epub 2018 Apr 19. PMID: 29671914; PMCID: PMC5969245.
15. Torres JR, Falleiros-Arlant LH, Dueñas L, Pleitez-Navarrete J, Salgado DM, Castillo JB. Congenital and perinatal complications of chikungunya fever: a Latin American experience. Int J Infect Dis. 2016 Oct;51:85-88. doi: 10.1016/j.ijid.2016.09.009. Epub 2016 Sep 13. PMID: 27619845.
16. Ramful D, Carbonnier M, Pasquet M, Bouhmani B, Ghazouani J, Noormahomed T, Beullier G, Attali T, Samperiz S, Fourmaintraux A, Alessandri JL. Mother-to-child transmission of Chikungunya virus infection. Pediatr Infect Dis J. 2007 Sep;26(9):811-5. doi: 10.1097/INF.0b013e3180616d4f. PMID: 17721376.
17. Chusri S, Siripaitoon P, Hirunpat S, Silpapojakul K. Case reports of neuro-Chikungunya in southern Thailand. Am J Trop Med Hyg. 2011 Aug;85(2):386-9. doi: 10.4269/ajtmh.2011.10-0725. PMID: 21813863; PMCID: PMC3144841.
18. Ganesan K, Diwan A, Shankar SK, Desai SB, Sainani GS, Katrak SM. Chikungunya encephalomyeloradiculitis: report of 2 cases with neuroimaging and 1 case with autopsy findings. AJNR Am J Neuroradiol. 2008 Oct;29(9):1636-7. doi: 10.3174/ajnr.A1133. Epub 2008 Jun 19. PMID: 18566010.
19. Bandeira AC, Campos GS, Sardi SI, Rocha VF, Rocha GC. Neonatal encephalitis due to Chikungunya vertical transmission: First report in Brazil. IDCases. 2016 Jul 25;5:57-9. doi: 10.1016/j.idcr.2016.07.008. PMID: 27500084; PMCID: PMC4971151.
20. Maria A, Vallamkonda N, Shukla A, Bhatt A, Sachdev N. Encephalitic presentation of Neonatal Chikungunya: A Case Series. Indian Pediatr. 2018 Aug 15;55(8):671-674. PMID: 30218513.
21. Garcia-Lloret M, McGhee S, Chatila TA. Immunoglobulin replacement therapy in children. Immunol Allergy Clin North Am. 2008 Nov;28(4):833-49, ix. doi: 10.1016/j.iac.2008.07.001. PMID: 18940577; PMCID: PMC2585601.
22. Dhalla F, Misbah SA. Secondary antibody deficiencies. Curr Opin Allergy Clin Immunol. 2015 Dec;15(6):505-13. doi: 10.1097/ACI.0000000000000215. PMID: 26406183.
23. Fernandes AIV, Souza JR, Silva AR, Cruz SBSC, Castellano LRC. Immunoglobulin Therapy in a Patient with Severe Chikungunya Fever and Vesiculobullous Lesions. Front Immunol. 2019;10:1498. Published 2019 Jul 2. doi:10.3389/fimmu.2019.01498
24. Scott SSO, Braga-Neto P, Pereira LP, et al. Immunoglobulin-responsive chikungunya encephalitis: two case reports. J Neurovirol. 2017;23(4):625-631. doi:10.1007/s13365-017-0535-y






