Número atual: 21(3) - Dezembro 2021
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisao
Acidente vascular encefálico perinatal e infantil: definições, epidemiologia, classificações, fatores de risco, etiologias, investigação diagnóstica e desfechos clínicos e no neurodesenvolvimento
Perinatal and childhood stroke: definitions, epidemiology, classifications, risk factors, etiologies, diagnostic approach, and clinical and neurodevelopmental outcomes
Bruno Leonardo Scofano Dias; Fernanda Marinho de Lima
DOI:10.31365/issn.2595-1769.v21i3p123-138
Rede SARAH de Hospitais de Reabilitação, Pediatria do desenvolvimento e comportamento - Rio de Janeiro - RJ - Brasil
Endereço para correspondência:
Recebido em: 03/02/2021
Aprovado em: 24/02/2021
Instituição: Rede SARAH de Hospitais de Reabilitação - Rio de Janeiro - RJ - Brasil
Resumo
INTRODUÇÃO: Os acidentes vasculares encefálicos em crianças são mais frequentes em neonatos, estando associados a consequências clínicas e ao neurodesenvolvimento, resultando em impacto para toda a família.
OBJETIVO: Apresentar uma síntese atualizada do conhecimento sobre acidentes vasculares encefálicos em pediatria, expandir as informações dos estudos publicados nos últimos cinco anos e fomentar mais pesquisas nesta área do conhecimento no Brasil.
FONTES DE DADOS: Bases de dados Pubmed, LILACS e MEDLINE.
SÍNTESE DOS DADOS: Os acidentes vasculares encefálicos são classificados nos tipos perinatal e infantil. O tipo perinatal ocorre entre 20 semanas de vida fetal e 28 dias de vida pós-natal; divide-se no subtipo perinatal agudo sintomático com apresentação nos primeiros 28 dias de vida pós-natal, sendo este subdividido em neonatal isquêmico arterial, trombose de seio venoso cerebral neonatal e neonatal hemorrágico; e no subtipo perinatal presumido com apresentação após os primeiros 28 dias de vida pós-natal, sendo este subdividido em perinatal isquêmico arterial presumido, infarto venoso periventricular e perinatal hemorrágico presumido. O tipo infantil ocorre e se apresenta após 28 dias de vida pós-natal até 18 anos de idade, sendo subclassificado em isquêmico arterial, trombose de seio venoso cerebral e hemorrágico.
CONCLUSÕES: Nos últimos cinco anos, estudos trouxeram novas informações. Uma nova classificação para o tipo perinatal e modificações na investigação diagnóstica. Ampliação na miríade de etiologias para os subtipos infantis isquêmicos e nas suas investigações diagnósticas, com uma nova classificação internacional para o subtipo arterial. Novas escalas específicas disponíveis para mensuração de desfechos e de qualidade de vida.
Palavras-chave: Recém-Nascido. Lactente. Criança. Adolescente. Acidente Vascular Cerebral.
Abstract
INTRODUCTION: Strokes in children are more frequent in neonates, and are associated with clinical and neurodevelopmental consequences, resulting in impact for the whole family.
OBJECTIVE: To present an updated synthesis of knowledge about strokes in pediatrics, expand the information of studies published in the last five years and encourage more research in this area of knowledge in Brazil.
DATA SOURCES: Pubmed, LILACS and MEDLINE databases.
DATA SYNTHESIS: Strokes are classified as perinatal and childhood types. The perinatal strokes occur between 20 weeks of fetal life and 28 days of postnatal life, are divided into symptomatic acute perinatal stroke with presentation in the first 28 days of postnatal life, which is subdivided into neonatal arterial ischemic stroke, neonatal cerebral sinovenous thrombosis and neonatal hemorrhagic stroke; and presumed perinatal strokes with presentation after the first 28 days of postnatal life, which is subdivided into arterial presumed perinatal ischemic stroke, periventricular venous infarction and presumed perinatal hemorrhagic stroke. Childhood strokes occur and present after 28 days of postnatal life up to 18 years, being subclassified in arterial ischemic stroke, cerebral sinovenous thrombosis and hemorrhagic stroke.
CONCLUSIONS: In the last 5 years studies have brought new information. A new classification for the perinatal strokes and changes in diagnostic investigation. Expansion in the myriad of etiologies for ischemic childhood strokes and in their diagnostic investigations, with a new international classification for the arterial ischemic stroke. New specific scales are available for measuring outcomes and quality of life.
Keywords: Animals, Newborn. Infant. Child. Adolescent. Stroke.
INTRODUÇÃO
A definição de acidente vascular encefálico (AVE) como "sinais e sintomas neurológicos de início agudo atribuídos a infarto ou hemorragia focal cerebral" também se aplica às crianças1. A incidência de AVE em crianças é maior em neonatos (25-40 / 100.000 nascidos vivos por ano) do que em crianças com mais de 28 dias de vida pós-natal (13 / 100.000 nascidos vivos por ano)2.
A classificação geral dos AVE em crianças é organizada basicamente em AVE perinatal e AVE infantil. O AVE perinatal ocorre entre 20 semanas de vida fetal e 28 dias de vida pós-natal; é subclassificado em AVE perinatal agudo sintomático (AVEPAS), com apresentação clínica nos primeiros 28 dias de vida pós-natal e AVE perinatal presumido (AVEPP) com apresentação clínica após os primeiros 28 dias de vida pós-natal. O AVE infantil (AVEI) ocorre e se apresenta clinicamente após 28 dias de vida pós-natal até 18 anos de idade1,2,3.
A apresentação clínica varia conforme a idade, a artéria envolvida e os fatores de risco. As crianças mais novas geralmente apresentam sintomas inespecíficos, como crises convulsivas e estado mental alterado, sobretudo as menores de um ano, enquanto as crianças mais velhas apresentam déficits neurológicos focais2. Principalmente no período neonatal, a apresentação aguda pode não ser reconhecida. Por isso, é importante que pediatras e profissionais de saúde que trabalham em pediatria sejam capazes de reconhecer sinais e sintomas de AVE em diferentes idades, com visando tratar precocemente, preservar as funções cerebrais e promover reparo e recuperação1.
O AVE durante a infância está associado a amplos déficits no neurodesenvolvimento e a outras morbidades4,5,6,7,8. Esses desfechos resultam em impacto para toda a família e em custos econômicos substanciais para a sociedade2,9.
Esta revisão tem como objetivo apresentar uma síntese atualizada do conhecimento disponível sobre AVE em pediatria, expandindo as informações dos estudos publicados nos últimos cinco anos, que podem servir como base para o fomento de pesquisas nessa área de conhecimento no Brasil.
MÉTODOS
Realizou-se revisão não sistemática da literatura referente a AVE em crianças em novembro de 2020 nas bases de dados Pubmed, LILACS e MEDLINE, utilizando como filtro os últimos cinco anos e as seguintes palavras-chave: "Infant, Newborn"; "Infant"; "Child, Preschool"; "Child"; "Adolescent"; e "Stroke". Foram recuperados 2.362 artigos, dos quais 257 foram excluídos por estarem disponíveis em idiomas que não inglês, espanhol, português e francês, ou porque os pesquisadores não tiveram acesso ao texto completo. Dos 2.105 artigos restantes, 59 foram utilizados como referências bibliográficas.
RESULTADOS E DISCUSSÃO
Acidente vascular encefálico perinatal (AVEP)
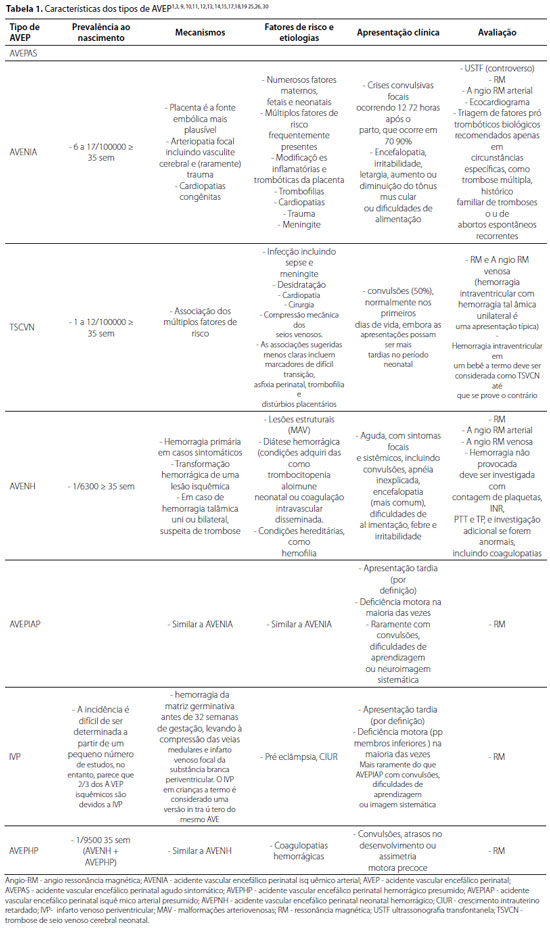
Inclui todo evento cerebrovascular ocorrido entre 20 semanas de vida fetal e 28 dias de vida pós-natal. Ambas as apresentações, AVEPAS e AVEPP, podem ser arteriais ou venosas, hemorrágicas ou isquêmicas, ou ambos1,3, 9,10,11,12. As características gerais dos AVEP estão resumidas na tabela 1.
Acidente vascular encefálico perinatal agudo sintomático (AVEPAS)
AVE arterial ou venoso / isquêmico ou hemorrágico, ocorrido em neonatos próximos do termo ou a termo, com apresentação logo após a ocorrência, responsável por aproximadamente 50% dos AVEP. Está subdividido em AVE neonatal isquêmico arterial (AVENIA), AVE neonatal hemorrágico (AVENH) e trombose de seio venoso cerebral neonatal (TSVCN). Aproximadamente 80% dos AVEPAS são por AVENIA1,3,14.
As apresentações mais comuns (70-90%) são convulsões focais ou generalizadas, 12-72 horas após o parto. AVE é a segunda causa mais comum de convulsão em neonatos a termo. Encefalopatia ocorre em 36-63%, com irritabilidade e hipertonia ou letargia e hipotonia. A ressonância magnética (RM) é o padrão ouro para o diagnóstico e para diferenciar AVE de lesão hipóxico-isquêmica difusa. A angiorressonância magnética (Angio-RM) arterial ou venosa é útil para detectar anormalidades vasculares15.
AVE neonatal isquêmico arterial (AVENIA)
AVE ocorrido em neonatos próximos do termo ou a termo, com interrupção focal do fluxo sanguíneo cerebral arterial e apresentação típica entre 12-72 horas após o parto9,12,13. Varia em ocorrência entre 1:10.000 e 1:3.500 neonatos, dependendo do estudo. Os AVE isquêmicos arteriais são cerca de seis vezes mais frequentes em neonatos relação a crianças maiores16.
O AVENIA é uma das principais causas de lesão cerebral perinatal e de deficiência ao longo da vida17. A artéria cerebral média é tipicamente acometida e o lado esquerdo (80%) predomina. O envolvimento do córtex cerebral aumenta o risco de convulsões1,9.
A placenta desempenha papel fundamental na fisiopatologia, sendo a fonte embólica mais plausível13,18. Quando realizada análise anatomopatológica, um distúrbio placentário é encontrado em 80% dos casos na forma de vasculopatia trombótica placentária fetal ou corioamnionite com endovasculite fetal13. A corioamnionite promove arteriopatia fetal difusa e formação de trombos. Outros fatores maternos, fetais, independentes (primiparidade, sexo masculino), intraparto e relacionados a asfixia no parto também influenciam na ocorrência do AVENIA13,19,20. Trombofilias eram consideradas fatores de risco, mas estudos recentes não demonstraram associação com AVENIA. Além disso, não parecem alterar o manejo agudo e de longo prazo, o desfecho e, notadamente, o risco de recorrência1,12,13,14,15,21. Outros fatores etiológicos/de risco neonatais são cardiopatias congênitas, outras coagulopatias, infecções, fatores genéticos e trauma1,12,13.
A maioria dos estudos converge para uma origem multifatorial, e o risco aumenta drasticamente quando esses fatores são cumulativos1,13,22,23. As apresentações mais comuns (70-90%) são crises convulsivas (focais ou generalizadas), ocorrendo tipicamente 12-72 horas após o parto3,9,12. O início fora das primeiras horas de vida ajuda a distinguir AVENIA de outras causas de convulsão neonatal9, convulsões que ocorrem <12 h após o nascimento são incomuns no AVENIA e apontam para encefalopatia hipóxico-isquêmica (EHI). No entanto, padrões mistos (com encefalopatia) são possíveis13, tornando difícil a diferenciação entre AVENIA de EHI24. A tabela 2 resume os dos principais fatores de risco e de neuroimagem no AVENIA e na EHI.
A RM por difusão é o padrão ouro para o diagnóstico, idealmente com imagens vasculares de angio-RM9,25. A ultrassonografia transfontanela e a tomografia óptica difusa são opções alternativas para investigação precoce17,23,26. Avaliações para trombofilias não são mais indicadas na ausência de outros fatores de risco9,21. Em circunstâncias específicas, como trombose múltipla, histórico familiar de eventos trombóticos e histórico materno de abortos recorrentes, a triagem de fatores biológicos pró-trombóticos ainda é recomendada13.
A recorrência após o AVENIA ocorre em 1-2% dos casos e afeta predominantemente recém-nascidos com fatores de risco conhecidos, como cardiopatias congênitas13,14,22. A maioria das crianças com AVENIA evolui com déficits neurológicos, a maior parte com paralisia cerebral (68%), com pelo menos mais uma comorbidade clínica, epilepsia (47%) e/ou do neurodesenvolvimento (59%)1.
O AVENIA de circulação posterior é menos frequente em recém-nascidos do que em crianças, e não difere do AVENIA em apresentação clínica, fatores de risco, diagnóstico por imagem, complicações e recorrência27. O AVENIA cerebelar é ainda mais raro, principalmente em recém-nascidos a termo13,28.
Trombose de seio venoso cerebral neonatal (TSVCN)
Presença de trombos em um ou mais seios venosos ou veias cerebrais com apresentação clínica nos primeiros 28 dias de vida pós-natal, com infarto venoso parenquimatoso de natureza hemorrágica9,13. Incidência estimada de 1-12 por 100.000 nascidos vivos, com predomínio do sexo masculino9,12,13. Estudos sugerem associações com infecções, incluindo sepse e meningite, desidratação, doença cardíaca, cirurgias e compressão mecânica dos seios venosos, e menos claramente, com marcadores de difícil transição, asfixia perinatal, trombofilias e distúrbios placentários1,9,12.
A apresentação mais comum (50%) é de crises convulsivas, geralmente nos primeiros dias de vida, mas pode ser inespecífica, com letargia e irritabilidade9,12,29. O diagnóstico é confirmado com RM e angio-RM venosa, que podem caracterizar alterações parenquimatosas associadas, variando de congestão venosa e infarto a conversão hemorrágica1,12,13. A hemorragia intraventricular com hemorragia talâmica unilateral é a apresentação típica da TSVCN12,13,30. Hemorragia intraventricular em neonatos a termo deve ser considerada como TSVCN até prova em contrário. Condições protrombóticas devem ser avaliadas geneticamente se existir histórico familiar12.
A alta incidência de hemorragia intracraniana e de condições comórbidas explica a taxa de mortalidade de até 19%. A maioria das crianças sobreviventes exibe comprometimento do neurodesenvolvimento e epilepsia. Desfecho adverso é predisposto por infarto parenquimatoso, envolvimento bilateral e comorbidades neurológicas13. Recém-nascidos a termo, com TSVCN e hemorragia talâmica estão em risco para epilepsia de início tardio, com pico e onda contínua durante o sono ou espectro relacionado, que pode levar a sequelas intelectuais e comportamentais13,30.
Acidente vascular encefálico neonatal hemorrágico (AVENH)
AVE ocorrido em neonatos próximos do termo ou a termo, envolvendo uma coleção focal de sangue no parênquima cerebral, apresentando encefalopatia, convulsões, estado mental alterado ou déficit neurológico nos primeiros 28 dias pós-parto. Não se refere a hemorragias da matriz germinal ou a hemorragias intraventriculares em bebês prematuros1,3,9,12,13. Afeta 1: 6.300 nascidos vivos, incluindo hemorragia idiopática primária e transformação hemorrágica de infartos arteriais ou venosos1,9,12,13,31, e está associado a mortalidade significativa relacionada a extensão da hemorragia inicial13.
Lesões estruturais e diátese hemorrágica são causas definitivas de AVENH. Malformações arteriovenosas (MAV) podem estar sujeitas a ruptura no nascimento, quando a transição para a vida extrauterina resulta em alterações importantes na pressão arterial12. Condições adquiridas como trombocitopenia aloimune neonatal ou coagulação intravascular disseminada ou condições hereditárias como hemofilia, também podem estar presentes1,31,12. Alguns estudos sugerem que marcadores de difícil transição podem ser fatores de risco. Mutações no COL4A1 devem ser consideradas em neonatos com hemorragia cerebral, porencefalia, glaucoma ou catarata1,31.
As apresentações incluem convulsões, apneia, encefalopatia (mais comum) e irritabilidade1,9,13,31. A RM é a investigação diagnóstica de escolha, com sequências sensíveis ao sangue combinadas com sequências parenquimatosas, podendo estimar a idade do sangramento. A imagem ponderada por difusão avalia a lesão isquêmica primária subjacente no caso de transformação hemorrágica. Angio-RM arterial e angio-RM venosa avaliam as possíveis etiologias9,12,13,30. O lobo temporal é o sítio mais comum do AVENH idiopático9,12,31. Contagem de plaquetas, INR, PTT e PT são indicados e, se anormais, coagulopatias hereditárias devem ser investigadas12.
O risco de recorrência é baixo e a ocorrência de epilepsia varia de 10-15%. O desfecho em longo prazo para os sobreviventes costuma ser melhor do que no AVENIA. O resultado é pior quando o AVENH está associado a EHI ou a uma condição deletéria crônica, como hemofilia13,31.
Acidente vascular encefálico perinatal presumido (AVEPP)
AVE arterial ou venoso / isquêmico ou hemorrágico cuja época exata de ocorrência no período perinatal não pode ser determinada, em nascidos próximos do termo ou a termo, com apresentação após os primeiros 28 dias de vida pós-natal1,3,9,10,11,12,13. A prevalência é subestimada devido à apresentação sutil e tardia13. É subdividido em acidente vascular encefálico perinatal isquêmico arterial presumido (AVEPIAP), infarto venoso periventricular (IVP) e acidente vascular encefálico hemorrágico perinatal presumido (AVEHPP)1,3,9,10,11,12,13.
Pode ser suspeitado durante o controle ultrassonográfico de rotina e confirmado por meio de RM pré-natal em crianças com fatores de risco. No entanto, a maioria não é identificada durante o pré-natal e terá um parto normal ou minimamente complicado, sem sinais ou sintomas durante o período neonatal3,10. Manifesta-se geralmente como uma preferência precoce pelo uso de uma das mãos e/ou com marcos motores atrasados e/ou crises focais ou espasmos infantis3. Distonia de início tardio e a maioria das sequelas intelectuais ou de linguagem podem ser observadas anos após o diagnóstico10.
Acidente vascular encefálico perinatal isquêmico arterial presumido (AVEPIAP)
AVEPP determinado por interrupção focal do fluxo sanguíneo arterial cerebral9,11,12,13. É uma forma de apresentação tardia de AVENIA, com apresentações, achados de imagem e desfechos semelhantes, provavelmente com diferentes mecanismos patogênicos ainda não compreendidos9,11,12.
O diagnóstico definitivo do AVEPIAP é atrasado por meses (geralmente antes de um ano de vida) ou mesmo anos10,12. O acometimento motor unilateral é a apresentação mais comum. De forma menos frequente, pode se apresentar na educação infantil ou na idade escolar (3-10 anos) com dificuldades de aprendizagem, intelectuais, visuais ou com epilepsia9,10. A RM confirma a suspeita clínica13. O caráter crônico da lesão é indicado pela ausência de restrição na imagem de difusão e na presença de encefalomalácia, gliose, atrofia ou degeneração walleriana. Assim como no AVENIA, não é necessária a investigação adicional para trombilias10.
Infarto venoso periventricular (IVP)
AVE ocorrido antes da 32ª semana de gestação, causado por hemorragia da matriz germinal, que leva a compressão das veias medulares e infarto venoso focal da substância branca periventricular, tipicamente diagnosticado em neonatos nascidos a termo, com apresentação após 28 dias de vida pós-natal 9,11,12,13. A incidência é difícil de determinar devido ao pequeno número de estudos; no entanto, dois terços dos AVEP isquêmicos são devidos a IVP13.
Não é associado a nenhuma complicação intraparto ou a uma transição difícil. Poderiam existir associações com distúrbios genéticos da integridade vascular, como a mutação de COL4A1 (subunidade do colágeno tipo IV ligada a angiogênese) que predisporiam à hemorragia da matriz germinativa9,11,12,13.
A apresentação mais comum é a preferência manual precoce, geralmente óbvia após 4-6 meses, mas o diagnóstico é comumente atrasado para uma mediana de 18 meses12,13. Comparativamente ao AVEPIAP, o IVP tem maior probabilidade de apresentar sintomas motores isolados, o membro inferior é mais afetado e é improvável que se apresente com convulsões ou atrasos intelectuais, devido à preservação do córtex. Com diagnóstico clínico-radiológico, a RM evidencia aumento porencefálico unilateral do ventrículo lateral com prolongamento em T2 da substância branca periventricular e cápsula interna, mas poupando o córtex e os núcleos da base. A evidência da hemorragia da matriz germinativa fetal remota subjacente ao IVP em sequências sensíveis à hemorragia adiciona mais certeza ao diagnóstico. Como o IVP é relacionado a fatores de risco genéticos ou possivelmente intraútero, e não há associação com condições pró-trombóticas, não há necessidade de mais investigações9,12.
Acidente vascular encefálico perinatal hemorrágico presumido (AVEPHP)
AVE cuja época exata de ocorrência no período perinatal não pode ser determinada, em nascidos próximos do termo ou a termo, com hemorragia focal remota e apresentação após 28 dias de vida pós-natal9,12,31.
As apresentações clínicas podem incluir convulsões, atraso no desenvolvimento ou assimetria motora precoce. É diagnosticado por RM com as mesmas sequências usadas no AVENH para identificar fatores de risco associados, como MAV9,13. Exames laboratoriais devem ser realizados para avaliar diáteses hemorrágicas9,12,13. Caso associado a catarata congênita, alterações extensas na substância branca na imagem ou na presença de uma história familiar sugestiva, mutações COL4A1 devem ser pesquisadas13.
Acidente vascular encefálico infantil (AVEI)
AVE ocorrido após os 28 primeiros dias de vida pós-parto até 18 anos de idade1. É dividido em AVEI isquêmico (AVEII) e hemorrágico (AVEIH). O AVEII representa 55% dos AVEI, sendo subdividido em AVEII arterial (AVEIIA), devido à perda de fluxo arterial, e trombose de seio venoso cerebral (TSVC) por infarto venoso, devido à perda de fluxo em uma veia cerebral de drenagem ou seio venoso3. AVEIH é definido como uma hemorragia arterial ou venosa intraparenquimatosa cerebral espontânea não traumática3,32.
O AVEII afeta 1 a 2:100.000 crianças (não neonatos)/ano nos países ocidentais desenvolvidos. A incidência é mais alta naqueles < 5 anos de idade e nos meninos1.
Mais de 60% das crianças com AVEII ou AVEIH apresentam sinais e sintomas generalizados e/ou não habituais, como cefaleia (20-50%) e estados mentais alterados (17-50%). Crises convulsivas no momento da ocorrência da AVE são mais comuns em crianças (15-46%) do que em adultos (5%), especialmente naqueles < 6 anos de idade3.
AVE infantil isquêmico arterial (AVEIIA)
A incidência do AVEIIA é de 2:100.000 crianças por ano; já em outros estudos da Ásia e da Europa, varia de 0,2 a 7,9:100.000 crianças/ano33. Aproximadamente 40% das crianças com AVEIIA terão um fator clínico associado, e cerca de 50% terão dois ou mais fatores. Em pelo menos 10% dos casos nenhum fator de risco é identificado3.
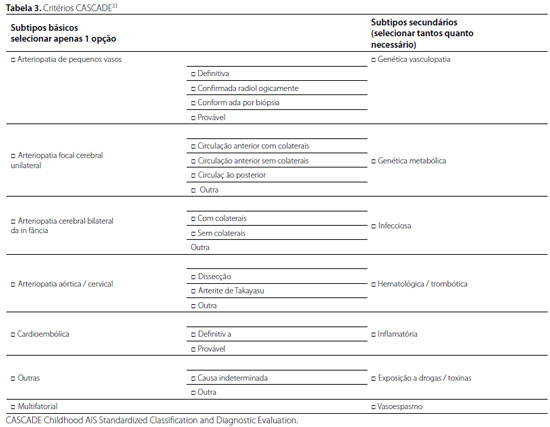
O International Pediatric Stroke Study criou um sistema de classificação de AVEIIA: os critérios CASCADE (Childhood AIS Standardized Classification and Diagnostic Evaluation) utilizados internacionalmente atualmente (Tabela 3). A classificação primária é baseada no sítio anatômico da doença em sete subtipos. Os 19 subtipos secundários incluem informações etiológicas adicionais33,34. Pacientes classificados como CASCADE 2 (arteriopatia cerebral focal unilateral), 3 (arteriopatia cerebral bilateral) e 5 (cardioembolia) têm um risco aumentado de recorrência35.
Arteriopatia é definida como estenose patológica, oclusão ou irregularidade das artérias cerebrais; podendo ser causada por anomalia genética ou por etiologia adquirida, é o fator de risco mais comum para AVEIIA (53% dos casos) e aumenta o risco de recorrência para 66%3,34.
As arteriopatias extracranianas são geralmente causadas por dissecção craniocervical arterial (DCCA), tendo como fatores de risco: gênero masculino, traumas cranianos e cervicais, e desordens do tecido conjuntivo. DCCA representa 7,5% dos AVEIIA. O diagnóstico é feito por angio-RM arterial1,36. Dissecção e pseudoaneurisma no segmento V3 (região de C1-C2) da artéria vertebral é uma entidade única, ocorrendo especialmente em meninos com AVEIIA de circulação posterior (AVEIIACP); é atribuída a traumas arteriais de repetição por rotação cervical e tem alta taxa de recorrência (até 19% em 3 anos)1.
As arteriopatias intracranianas são responsáveis por até 45% dos AVEIIA e apresentam altas taxas de recorrência (19-25%)37. A doença falciforme (DF) - incluindo anemia falciforme (hemoglobinopatia homozigótica SS) e outras hemoglobinopatias hereditárias, tais como SC, S/beta e S/beta+talassemia (S/b) e SD Punjab - é uma das arteriopatias (estenose arterial, oclusão ou friabilidade) mais associadas ao AVEIIA38. O AVEIIA ocorre em 11% dos pacientes com DF até 20 anos (chance 200 vezes maior em relação a crianças sem DF), com risco de recorrência de até 70%3.
A síndrome de Moyamoya é um estreitamento progressivo das artérias carótida interna distal ou proximal anterior ou cerebral média. É característica a aparência de "nuvem de fumaça" dos vasos colaterais compensatórios na angiografia convencional. Pode ser idiopática e é relatada em associação com uma ampla gama de condições clínicas e doenças genéticas. O risco de recorrência em um ano é de 35%37. Geralmente é bilateral, mas pode ser unilateral, especialmente no início do processo da doença1.
AVE cardioembólicos são responsáveis por 30% dos AVEIIA e podem ocorrer como resultado de cardiopatias congênitas ou adquiridas e/ou eventos relacionados a procedimentos1,3. Indica-se ecocardiograma transtorácico com estudo de bolhas, bem como monitoramento para arritmias1.
Condições protrombóticas congênitas e adquiridas são causas de AVEIIA. Treze por cento das crianças com AVEIIA apresentam trombofilia hereditária. História familiar de três gerações com AVE, infarto do miocárdio antes dos 50 anos, trombose venosa profunda não provocada ou embolia pulmonar e mulheres com doi ou mais abortos espontâneos são indicadores. Investigação para trombofilias está indicada, mesmo sem histórico familiar, pois afeta o tipo ou a duração da terapia para profilaxia de AVEIIA3. As trombofilias incluem níveis aumentados de proteínas (lipoproteína [a]), níveis reduzidos de inibidores da coagulação (proteína C e antitrombina) ou mutações genéticas que resultem na incapacidade de inibição de proteínas durante a hemostasia (mutação no gene da protrombina e mutação no fator V de Leiden) ou a produção de um composto anormal (aumento dos níveis de homocisteína resultantes de polimorfismo no gene da metilenotetra-hidrofolato redutase). As condições adquiridas incluem a presença de proteínas anormais (anticorpos antifosfolípides - anticoagulante lúpico, anticorpos anticardiolipina, ou anti-β2 glicoproteína Ib)39. Condições adquiridas também predispõem ao AVEIIA. Enxaqueca com aura, mas não a enxaqueca sem aura, duplica o risco de AVE em adolescentes. As pílulas anticoncepcionais orais contendo estrogênio acarretam risco 2 a 2,5 vezes maior. O risco também aumenta durante a gravidez. Tanto as malignidades sistêmicas quanto seu tratamento aumentam o risco de AVEIIA3.
Infecções estão presentes em uma entre cada três crianças no momento do AVEIIA. Infecções dentro de três dias antes do AVEIIA contribuem como um fator de risco significativo, e infecções semanas antes do AVEIIA são fatores de risco. A arteriopatia pós-varicela é uma arteriopatia focal cerebral ocorrida < 1 ano após a varicela, sendo uma doença unilateral que afeta a artéria carótida interna supraclinoide ou as artérias cerebrais proximal anterior ou média, com nenhuma outra causa identificada40. As infecções de cabeça e pescoço fora do cérebro (otite média, sinusite e infecções no pescoço) podem promover a formação de trombos nas artérias adjacentes, algumas das quais se comunicam com o sistema intracraniano. A meningite é complicada por AVEIIA em até 25% dos casos, e os vasos cerebrais que percorrem as meninges inflamadas podem desenvolver vasculite, vasoespasmo e trombose1,3.
As etiologias sistêmicas são menos comuns1. Etiologias inflamatórias focais e sistêmicas aumentam o risco de AVEIIA. A angeíte primária do sistema nervoso central (APSNC) pode ser monofásica, levando a AVEIIA, ou pode ser progressiva com cefaleia, alterações neurocognitivas e transtornos do humor3,38. A presença persistente de biomarcadores inflamatórios (proteína C reativa e taxa de sedimentação de eritrócitos) além de um mês após o AVE, doença renal, proteinúria, nódulos nas mãos, febre frequente e livedo reticular sugerem doença inflamatória progressiva, como lúpus eritematoso sistêmico, deficiência de adenosina desaminase 2 ou poliarterite nodosa1,41.
Existem etiologias genéticas/metabólicas como síndrome ACTA2 (autossômica dominante com infartos subcorticais de substância branca e carótidas internas ectásicas bilateralmente, persistência do canal arterial, pupilas dilatadas e não reativas congênitas, dilatação do arco aórtico, hipertensão pulmonar, bexiga hipotônica e má rotação intestinal); mutações COL4A1 e síndrome PHACE (anomalias da fossa posterior, hemangioma, lesões arteriais, anormalidades cardíacas / coarctação da aorta, anomalias oculares)1,42. Mitocondriopatias podem causar episódios semelhantes a AVE distinguidos por suas lesões não estarem em uma distribuição arterial. A síndrome MELAS (encefalopatia mitocondrial, acidose láctica e episódios de AVE) normalmente se apresenta em uma criança anteriormente neurotípica, com histórico de enxaqueca e vômitos, com lesões predominantemente occipitais. Acidose láctica, hiperproteinorraquia e fibras vermelhas rasgadas na biópsia muscular são típicas da doença, embora o diagnóstico seja confirmado através do sequenciamento genético1,43. Deve-se suspeitar de distúrbios no espectro POLG1 em crianças com AVE e achados similares de RM nos quais há histórico de encefalopatia, estado de mal epiléptico ou atraso global do desenvolvimento pré-mórbido1,44.
AVEIIACP representa um padrão distinto de apresentação clínica, com idade média de apresentação de 7-8 anos, na maioria meninos previamente saudáveis45. Os sintomas de apresentação incluem déficits localizados (70-100%): hemiparesia, ataxia, disartria, defeitos de campo visual e déficits oculomotores. Sintomas não localizados ocorrem em 60-70%, principalmente cefaleia, vômitos e estados alterados de consciência1. O principal fator etiológico e de risco é a dissecção de artéria vertebral em 25-50% dos casos, principalmente em meninos mais jovens, frequentemente precedida por traumatismo craniano ou vertebral leve. Estudos reportam bons resultados em 61%46.
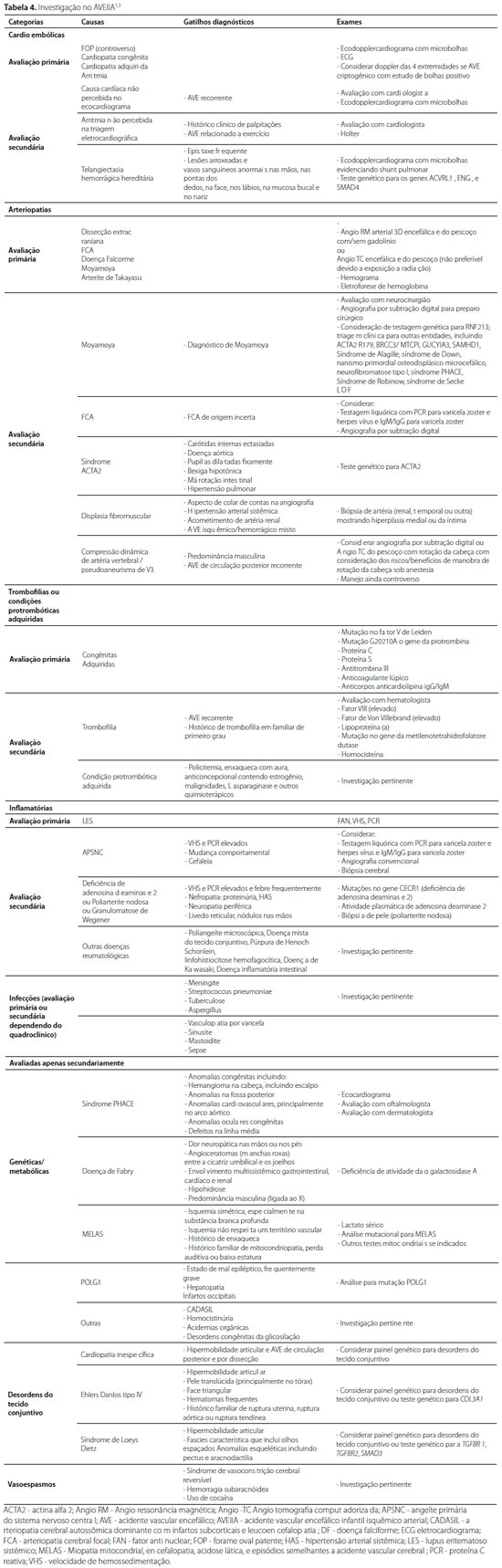
A abordagem diagnóstica no AVEIIA deve ser realizada em etapas. A avaliação primária é baseada na triagem para as causas mais comuns e deve tentar identificar aquelas que podem levar a AVE recorrente. Na avaliação secundária, uma avaliação mais aprofundada deve ser realizada em crianças com AVEIIA sem diagnóstico ou recorrente. A tabela 4 resume a investigação diagnóstica no AVEIIA.
Trombose de seio venoso cerebral (TSVC)
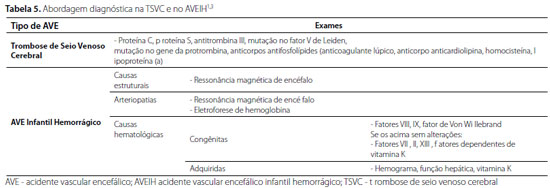
Trombose do sistema venoso dural superficial ou profundo, resultando em drenagem venosa prejudicada e hipertensão intracraniana. Se a pressão venosa é suficiente para comprometer o fluxo arterial, isquemia, infarto ou hemorragia podem ocorrer. Lesões cerebrais focais são observadas em até 50%1,47. Resulta frequentemente da convergência de múltiplos fatores de risco48,49. Até 60% têm uma trombofilia comparativamente com 15-25% dos adultos, com risco aumentado de TSVC recorrente1.
Outros fatores de risco incluem febre, anemia (especialmente ferropriva), desidratação e infecções, mais comumente de cabeça e pescoço (otite média, mastoidite, sinusite, celulite periorbitária e meningoencefalite)50; doença inflamatória intestinal, doença de Behçet, lúpus eritematoso sistêmico; homocistinúria; enteropatias, nefropatias, insuficiência hepática; cardiopatias congênitas; tireotoxicose1. Malignidades, particularmente leucemia linfoblástica aguda51 e tumores do sistema nervoso central. Medicamentos protrombóticos como esteroides e contraceptivos contendo estrogênio também foram associados à TSVC1.
Os sinais e sintomas podem inespecíficos, estão relacionados à idade e podem se sobrepor com sintomas de condições comórbidas. Lactentes e crianças mais velhas podem manifestar sinais de hipertensão intracraniana ou sinais e sintomas focais relacionados a infarto e hemorragia. A trombose do seio cavernoso tem apresentação mais específica, com proptose unilateral e paralisia dos nervos cranianos (III-VI)52. Pode ser clinicamente silenciosa, sobretudo quando diagnosticada em exames de imagem de rotina realizados após trauma craniano ou cirurgia de cabeça e pescoço. As crianças (25-74%) se saem pior do que adultos após TSVC. A presença de hemorragia no diagnóstico é preditiva de pior resultado. Crianças sem edema cerebral ou infarto venoso têm melhores desfechos. As taxas de epilepsia variam de 10-14%. As taxas de mortalidade variam de 0-23%1. A tabela 5 resume a investigação diagnóstica na TSVC.
AVE infantil hemorrágico (AVEIH)
As anomalias vasculares são responsáveis por cerca de 45% dos AVEIH não traumáticos. As crianças podem ter várias MAV, especialmente em síndromes genéticas, como telangiectasia hemorrágica hereditária ou MAV com aneurisma associado. Os aneurismas sintomáticos são relativamente raros em crianças, mas estão associados a condições como coarctação da aorta, doença renal policística, DF, Ehlers-Danlos tipo IV e displasia fibromuscular. MAV não rompidas ou outras conexões arteriovenosas diretas, como fístulas e malformações das veias de Galeno, podem se manifestar na infância, com insuficiência cardíaca de alto débito devido a shunt arteriovenoso e hidrocefalia devido ao efeito de massa. Crianças mais velhas com MAV ou aglomerados de capilares de parede fina, chamados "malformações cavernosas", podem desenvolver convulsões, cefaleia ou déficits neurológicos focais. O risco anual de hemorragia para MAV conhecidas é de 2-4%, e para malformações cavernosas é de 4,5%3,32. A tabela 5 resume a investigação diagnóstica no AVEIH.
AVE infantil cerebelar (AVEIC)
Qualquer lesão arterial cerebelar que ocupe espaço (grande infarto cerebelar com edema crescente ou hemorragia de crescimento rápido) pode levar à herniação descendente, através do forame magno ou a herniação ascendente, através da incisura tentorial. Em crianças, a frequência de AVEIC isquêmico é um pouco maior do que a de AVEIC hemorrágico e a probabilidade da ocorrência de sintomas graves em hemorragias cerebelares é significativamente maior em comparação com lesões isquêmicas53.
Condições que mimetizam AVE infantil
A grande maioria (60% a 90%) das crianças com uma síndrome neurológica aguda tem alguma outra condição que não AVE1. Muitos diagnósticos podem mimetizar um AVEI2,54. Deve-se pensar na possibilidade de AVEI como diagnóstico diferencial de déficits neurológicos de início súbito, incluindo convulsões e déficits não focais, mesmo em uma criança sem fatores de risco predisponentes. Sintomas focais são mais comuns em crianças com AVE do que naquelas com condições que o mimetizam, mas podem ocorrer em ambas. Sintomas não localizados como cefaleia e estados mentais alterados são igualmente comuns em ambos os grupos1,3. No quadro 1, estão resumidas as principais condições que mimetizam AVEI.
Desfechos em AVE perinatal e infantil
AVE está entre as dez principais causas de deficiências neurológicas, motoras e cognitivas de longo prazo e de morte em crianças55.
Nos AVEP os déficits motores predominam, mas a epilepsia e os transtornos de aprendizagem, do comportamento, da linguagem e da saúde mental agravam a morbidade12 e tendem a ocorrer em comorbidade, indicando vias interconectadas complexas no neurodesenvolvimento após lesão cerebral inicial13. O cérebro em desenvolvimento requer que as habilidades sejam adquiridas durante a trajetória de desenvolvimento, diferentemente do reaprender após a lesão do adulto12. Estas morbidades, combinadas com determinantes ambientais e psicossociais, afetam os aspectos cotidianos da vida da criança e da família13.
Estima-se que 50% dos neonatos e 65% das crianças com mais de um mês evoluirão com déficits motores duradouros após sofrerem um AVE2,8. Ao contrário dos adultos, convulsões acompanham o AVE em até 90% dos AVEP e em até 30% dos AVEI no quadro agudo. No AVEP, o risco de epilepsia subsequente excede 50%. Já no AVEI, o risco cumulativo de epilepsia ativa é de 13% em cinco anos, e de 30% em dez anos. Além disso, a ocorrência de crises convulsivas na apresentação do AVE agudo correlaciona-se com o desenvolvimento de epilepsia ativa, sendo os principais indicadores quanto maiores a quantidade e duração das convulsões e quanto mais jovens as crianças9. Os defeitos do campo visual foram os mais comumente relatados déficits visuais como sequelas tanto de AVEP e quanto de AVEI56.
Para além do acometimento motor e da epilepsia, estudos comprovam impactos do AVEI em diversos domínios psicossociais e na qualidade de vida da criança5; nas funções intelectuais, no funcionamento intelectual, na memória verbal, nas funções executivas, e na atenção6; na memória de trabalho7; e na frequência elevada de transtorno de déficit de atenção/hiperatividade8.
Escalas de mensuração de desfechos e de qualidade de vida no AVE em pediatria
A Pediatric Stroke Outcome Measure (PSOM) é uma escala de mensuração de desfecho padronizada e específica. É composta por uma primeira sessão de exame neurológico pediátrico, contendo 115 itens de testes que avaliam funções cognitivas, de linguagem, dos nervos cranianos, motoras, sensoriais, cerebelares e da marcha. A segunda sessão pontua um resumo de impressões contendo cinco subescalas: sensório-motor direito, sensório-motor esquerdo, produção de linguagem, compreensão de linguagem e cognitivo / comportamental57. O Pediatric Stroke Recurrence and Recovery Questionnaire (RRQ) é uma medida padronizada adaptada da PSOM pontuada pelos pais para avaliar a perspectiva dos pais sobre a função neurológica e a recuperação do AVE pediátrico. A RRQ é um estimador confiável da PSOM, sendo especialmente útil em estudos de resultados de longo prazo, quando os pacientes não podem retornar para avaliação física e pontuação pela PSOM58. Pediatric Stroke Quality of Life Measure (PSQLM) é um questionário preenchido pelos pais ou pelas crianças com 75 itens referentes a qualidade de vida infantil para pacientes de 2-18 anos com sequelas de AVEIIA e TSVC59.
Nenhuma das escalas acima é traduzida e validada para o português falado no Brasil e para cultura brasileira.
CONCLUSÃO
A literatura referente ao AVE em crianças é vasta e cresceu muito principalmente nos últimos cinco anos, como comprovado por todas as referências utilizadas nesta revisão. Tais estudos trazem novas informações. Uma nova forma de classificação para os AVEP com duas categorias (AVEPAS e AVEPP), cada uma com três subcategorias e modificações na investigação diagnóstica, mais focada nos períodos de ocorrência e de apresentação clínica e nos exames de neuroimagem e menos em exames laboratoriais, sobretudo aqueles referentes a trombofilias. Ampliam a miríade de etiologias para os AVEII em geral e as possibilidades de investigação diagnóstica, e chamam a atenção para uma nova forma de classificação internacional (CASCADE) para os AVEIIA. Ficam claras as possíveis repercussões clínicas e no neurodesenvolvimento e o impacto em geral nas vidas da criança/adolescente e de suas famílias, incluindo novas escalas específicas para mensuração de desfechos e de qualidade de vida. Poucos estudos foram realizados no Brasil, revelando a necessidade de mais pesquisas voltadas para o AVE em pediatria na população brasileira.
REFERÊNCIAS
1. Ferriero DM, Fullerton HJ, Bernard TJ, Billinghurst L, Daniels SR, DeBaun MR, deVeber G, Ichord RN, Jordan LC, Massicotte P, Meldau J, Roach ES, Smith ER. American Heart Association Stroke Council and Council on Cardiovascular and Stroke Nursing. Management of Stroke in Neonates and Children. A Scientific Statement From the American Heart Association/American Stroke Association. Stroke 2019 Mar;50(3):e51-e96. doi: 10.1161/STR.0000000000000183.
2. McKinney SM, Magruder JT, Abramo TJ. An Update on Pediatric Stroke Protocol. Pediatr Emerg Care. 2018 Nov;34(11):810-815. doi: 10.1097/PEC.0000000000001653.
3. Bernson-Leung ME, Rivkin MJ. Stroke in Neonates and Children. Pediatr Rev. 2016 Nov;37(11):463-477. doi: 10.1542/pir.2016-0002. PMID: 27803143.
4. O'Keeffe F, Stark D, Murphy O, Ganesan V, King J, Murphy T. Psychosocial outcome and quality of life following childhood stroke: A systematic review. Dev Neurorehabil. 2017 Oct;20(7):428-442. doi: 10.1080/17518423.2017.1282052. Epub 2017 Feb 16. PMID: 28632465.
5. Jacomb I, Porter M, Brunsdon R, Mandalis A, Parry L. Cognitive outcomes of pediatric stroke. Child Neuropsychol. 2018 Apr;24(3):287-303. doi: 10.1080/09297049.2016.1265102. Epub 2016 Dec 14. PMID: 27960625.
6. Fuentes A, Westmacott R, Deotto A, deVeber G, Desrocher M. Working memory outcomes following unilateral arterial ischemic stroke in childhood. Child Neuropsychol. 2017 Oct;23(7):803-821. doi: 10.1080/09297049.2016.1205008. Epub 2016 Jul 18. PMID: 27424626.
7. Williams TS, Roberts SD, Coppens AM, Crosbie J, Dlamini N, Westmacott R. Secondary attention-deficit/hyperactivity disorder following perinatal and childhood stroke: impact on cognitive and academic outcomes. Child Neuropsychol. 2018 Aug;24(6):763-783. doi: 10.1080/09297049.2017.1333091. Epub 2017 May 30. PMID: 28554265.
8. Rivkin MJ. Epilepsy as the 'echo' of acute stroke in children. Dev Med Child Neurol. 2017 Jan;59(1):6. doi: 10.1111/dmcn.13231. Epub 2016 Aug 13. PMID: 27519161.
9. Dunbar M, Kirton A. Perinatal stroke. Semin Pediatr Neurol. 2019 Dec;32:100767. doi: 10.1016/j.spen.2019.08.003.
10. Gacio S, Muñoz Giacomelli F, Klein F. Presumed perinatal ischemic stroke: A review. Arch Argent Pediatr. 2015 Oct;113(5):449-55. English, Spanish. doi: 10.5546/aap.2015.449. PMID: 26294151.
11. Ilves P, Laugesaar R, Loorits D, Kolk A, Tomberg T, Lõo S, Talvik I, Kahre T, Talvik T. Presumed Perinatal Stroke: Risk Factors, Clinical and Radiological Findings. J Child Neurol. 2016 Apr;31(5):621-8. Doi: 10.1177/0883073815609149.
12. Dunbar M, Kirton A. Perinatal stroke. Semin Pediatr Neurol. 2019 Dec;32:100767. doi: 10.1016/j.spen.2019.08.003.
13. Fluss J, Dinomais M, Chabrier S. Perinatal stroke syndromes: Similarities and diversities in aetiology, outcome and management. Eur J Paediatr Neurol. 2019 May;23(3):368-383. doi: 10.1016/j.ejpn.2019.02.013.
14. Lehman LL, Beaute J, Kapur K, Danehy AR, Bernson-Leung ME, Malkin H, Rivkin MJ, Trenor CC 3rd. Workup for Perinatal Stroke Does Not Predict Recurrence. Stroke. 2017 Aug;48(8):2078-2083. doi: 10.1161/STROKEAHA.117.017356. Epub 2017 Jul 13. PMID: 28706112.
15. Lehman LL, Khoury JC, Taylor JM, Yeramaneni S, Sucharew H, Alwell K, Moomaw CJ, Peariso K, Flaherty M, Khatri P, Broderick JP, Kissela BM, Kleindorfer DO. Pediatric stroke rates over 17 years: report from a population-based study. J Child Neurol. 2018;33:463-467. doi: 10.1177/0883073818767039.
16. Lee S, Mirsky DM, Beslow LA, Amlie-Lefond C, Danehy AR, Lehman L, Stence NV, Vossough A, Wintermark M, Rivkin MJ; International Paediatric Stroke Study Neuroimaging Consortium and the Paediatric Stroke Neuroimaging Consortium. Pathways for Neuroimaging of Neonatal Stroke. Pediatr Neurol. 2017 Apr;69:37-48. doi: 10.1016/j.pediatrneurol.2016.12.008. Epub 2017 Jan 26. PMID: 28262550.
17. deVeber GA, Kirton A, Booth FA, Yager JY, Wirrell EC, Wood E, Shevell M, Surmava AM, McCusker P, Massicotte MP, MacGregor D, MacDonald EA, Meaney B, Levin S, Lemieux BG, Jardine L, Humphreys P, David M, Chan AK, Buckley DJ, Bjornson BH. Epidemiology and outcomes of arterial ischemic stroke in children: the Canadian Pediatric Ischemic Stroke Registry. Pediatr Neurol. 2017;69:58-70. doi: 10.1016/j.pediatrneurol.2017.01.016.
18. Olivé G, Agut T, Echeverría-Palacio CM, Arca G, García-Alix A. Usefulness of Cranial Ultrasound for Detecting Neonatal Middle Cerebral Artery Stroke. Ultrasound Med Biol. 2019 Mar;45(3):885-890. doi: 10.1016/j.ultrasmedbio.2018.11.004. Epub 2019 Jan 11. PMID: 30642660.
19. Fluss J, Garcia-Tarodo S, Granier M, Villega F, Ferey S, Husson B, Kossorotoff M, Muehlethaler V, Lebon S, Chabrier S. Perinatal arterial ischemic stroke related to carotid artery occlusion. Eur J Paediatr Neurol. 2016 Jul;20(4):639-48. doi: 10.1016/j.ejpn.2016.03.003. Epub 2016 Mar 16. PMID: 27025300.
20. Guiraut C, Cauchon N, Lepage M, Sébire G. Perinatal Arterial Ischemic Stroke Is Associated to Materno-Fetal Immune Activation and Intracranial Arteritis. Int J Mol Sci. 2016 Nov 25;17(12):1980. doi: 10.3390/ijms17121980. PMID: 27898024; PMCID: PMC5187780.
21. Giraud A, Guiraut C, Chevin M, Chabrier S, Sébire G. Role of Perinatal Inflammation in Neonatal Arterial Ischemic Stroke. Front Neurol. 2017 Nov 16;8:612. doi: 10.3389/fneur.2017.00612. PMID: 29201015; PMCID: PMC5696351.
22. Curtis C, Mineyko A, Massicotte P, Leaker M, Jiang XY, Floer A, Kirton A. Thrombophilia risk is not increased in children after perinatal stroke. Blood. 2017 May 18;129(20):2793-2800. doi: 10.1182/blood-2016-11-750893. Epub 2017 Mar 3. Erratum in: Blood. 2017 Jul 20;130(3):382. PMID: 28258054.
23. Martinez-Biarge M, Cheong JL, Diez-Sebastian J, Mercuri E, Dubowitz LM, Cowan FM. Risk Factors for Neonatal Arterial Ischemic Stroke: The Importance of the Intrapartum Period. J Pediatr. 2016 Jun;173:62-68.e1. doi: 10.1016/j.jpeds.2016.02.064. Epub 2016 Apr 3. PMID: 27049002.
24. Li C, Miao JK, Xu Y, Hua YY, Ma Q, Zhou LL, Liu HJ, Chen QX. Prenatal, perinatal and neonatal risk factors for perinatal arterial ischaemic stroke: a systematic review and meta-analysis. Eur J Neurol. 2017 Aug;24(8):1006-1015. doi: 10.1111/ene.13337. Epub 2017 Jun 24. PMID: 28646492.
25. Adami RR, Grundy ME, Poretti A, Felling RJ, Lemmon M, Graham EM. Distinguishing Arterial Ischemic Stroke From Hypoxic-Ischemic Encephalopathy in the Neonate at Birth. Obstet Gynecol. 2016 Oct;128(4):704-12. doi: 10.1097/AOG.0000000000001631. PMID: 27607878; PMCID: PMC5895085.
26. Siddiq I, Armstrong D, Surmava AM, Dlamini N, MacGregor D, Moharir M, Askalan R. Utility of Neurovascular Imaging in Acute Neonatal Arterial Ischemic Stroke. J Pediatr. 2017 Sep;188:110-114. doi: 10.1016/j.jpeds.2017.05.046. Epub 2017 Jun 15. PMID: 28624098.
27. Chalia M, Dempsey LA, Cooper RJ, Lee CW, Gibson AP, Hebden JC, Austin T. Diffuse optical tomography for the detection of perinatal stroke at the cot side: a pilot study. Pediatr Res. 2019 Jun;85(7):1001-1007. doi: 10.1038/s41390-018-0263-x. Epub 2019 Feb 13. PMID: 30759451; PMCID: PMC6760550.
28. Goeggel Simonetti B, Rafay MF, Chung M, Lo WD, Beslow LA, Billinghurst LL, Fox CK, Pagnamenta A, Steinlin M, Mackay MT; IPSS Study Group. Comparative study of posterior and anterior circulation stroke in childhood: Results from the International Pediatric Stroke Study. Neurology. 2020 Jan 28;94(4):e337-e344. doi: 10.1212/WNL.0000000000008837. Epub 2019 Dec 19. PMID: 31857436.
29. Ecury-Goossen GM, van der Haer M, Smit LS, Feijen-Roon M, Lequin M, de Jonge RC, Govaert P, Dudink J. Neurodevelopmental outcome after neonatal perforator stroke. Dev Med Child Neurol. 2016 Jan;58(1):49-56. doi: 10.1111/dmcn.12857. Epub 2015 Jul 26. PMID: 26212612.
30. Benninger KL, Ruess L, Slaughter LA, Maitre NL, Rusin JA. Neonatal Vein of Labbé Infarction Size is Associated With Long-Term Language Outcomes. Pediatr Neurol. 2017 Jul;72:70-75.e1. doi: 10.1016/j.pediatrneurol.2017.03.015. Epub 2017 Apr 1. PMID: 28495146; PMCID: PMC5480620.
31. Merlini L, Hanquinet S, Fluss J. Thalamic Hemorrhagic Stroke in the Term Newborn: A Specific Neonatal Syndrome With Non-uniform Outcome. J Child Neurol. 2017 Jul;32(8):746-753. doi: 10.1177/0883073817703503. Epub 2017 Apr 21. PMID: 28429607.
32. Cole L, Dewey D, Letourneau N, Kaplan BJ, Chaput K, Gallagher C, Hodge J, Floer A, Kirton A. Clinical Characteristics, Risk Factors, and Outcomes Associated With Neonatal Hemorrhagic Stroke: A Population-Based Case-Control Study. JAMA Pediatr. 2017 Mar 1;171(3):230-238. doi: 10.1001/jamapediatrics.2016.4151. Erratum in: JAMA Pediatr. 2017 Jun 1;171(6):602. PMID: 28114647.
33. Gerstl L, Badura K, Heinen F, Weinberger R, Peraud A, Dorn F, Bonfert MV, Berweck S, O'Callaghan FJ. Childhood haemorrhagic stroke: a 7-year single-centre experience. Arch Dis Child. 2019 Dec;104(12):1198-1202. doi: 10.1136/archdischild-2018-316749. Epub 2019 Jun 20. PMID: 31221624.
34. Bernard TJ, Beslow LA, Manco-Johnson MJ, Armstrong-Wells J, Boada R, Weitzenkamp D, Hollatz A, Poisson S, Amlie-Lefond C, Lo W, deVeber G, Goldenberg NA, Dowling MM, Roach ES, Fullerton HJ, Benseler SM, Jordan LC, Kirton A, Ichord RN. Inter-rater reliability of the CASCADE criteria: challenges in classifying arteriopathies. Stroke. 2016;47:2443-2449. doi: 10.1161/STROKEAHA.116.013544.
35. Böhmer M, Niederstadt T, Heindel W, Wildgruber M, Sträter R, Hanning U, Kemmling A, Sporns PB. Impact of Childhood Arterial Ischemic Stroke Standardized Classification and Diagnostic Evaluation Classification on Further Course of Arteriopathy and Recurrence of Childhood Stroke. Stroke. 2018 Dec 7:STROKEAHA118023060. doi: 10.1161/STROKEAHA.118.023060. Epub ahead of print. PMID: 30580701.
36. Aborkhees G, Mitchell LG. Predicting risk for recurrence of arterial ischemic stroke in children: thrombophilia as another piece of the puzzle. Haematologica. 2019 Aug;104(8):1513-1514. doi: 10.3324/haematol.2019.222695. PMID: 31366465; PMCID: PMC6669139.
37. Uohara MY, Beslow LA, Billinghurst L, Jones BM, Kessler SK, Licht DJ, Ichord RN. Incidence of recurrence in posterior circulation childhood arterial ischemic stroke. JAMA Neurol. 2017;74:316-323. doi: 10.1001/jamaneurol.2016.5166.
38. Fullerton HJ, deVeber GA, Hills NK, Dowling MM, Fox CK, Mackay MT, Kirton A, Yager JY, Bernard TJ, Hod EA, Wintermark M, Elkind MS; VIPS Investigators. Inflammatory biomarkers in childhood arterial ischemic stroke: correlates of stroke cause and recurrence. Stroke. 2016;47:2221-2228. doi: 10.1161/STROKEAHA.116.013719.
39. Rodrigues DO, Ribeiro LC, Sudário LC, Teixeira MT, Martins ML, Pittella AM, Junior IO. Genetic determinants and stroke in children with sickle cell disease. J Pediatr (Rio J). 2016 Nov-Dec;92(6):602-608. doi: 10.1016/j.jped.2016.01.010. Epub 2016 Jun 5. PMID: 27268459.
40. Felling RJ, Sun LR, Maxwell EC, Goldenberg N, Bernard T. Pediatric arterial ischemic stroke: epidemiology, risk factors, and management. Blood Cells Mol Dis. 2017;67:23-33. doi: 10.1016/j.bcmd. 2017.03.003.
41. Chabrier S, Sébire G, Fluss J. Transient Cerebral Arteriopathy, Postvaricella Arteriopathy, and Focal Cerebral Arteriopathy or the Unique Susceptibility of the M1 Segment in Children With Stroke. Stroke. 2016 Oct;47(10):2439-41. doi: 10.1161/STROKEAHA.116.014606. Epub 2016 Sep 15. PMID: 27633022.
42. Steinlin M. Neuroinflammation in Ischemic Pediatric Stroke. Semin Pediatr Neurol. 2017 Aug;24(3):201-206. doi: 10.1016/j.spen.2017.08.006. Epub 2017 Sep 20. PMID: 29103427.
43. Garzon MC, Epstein LG, Heyer GL, Frommelt PC, Orbach DB, Baylis AL, Blei F, Burrows PE, Chamlin SL, Chun RH, Hess CP, Joachim S, Johnson K, Kim W, Liang MG, Maheshwari M, McCoy GN, Metry DW, Monrad PA, Pope E, Powell J, Shwayder TA, Siegel DH, Tollefson MM, Vadivelu S, Lew SM, Frieden IJ, Drolet BA. PHACE syndrome: consensus-derived diagnosis and care recommendations. J Pediatr. 2016;178:24-33.e2. doi: 10.1016/j.jpeds.2016.07.054.
44. Ko A, Lee SJ, Lee YM. Focal cerebellar infarction as an initial sign of mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episodes. J Inherit Metab Dis. 2019 May;42(3):575-576. doi: 10.1002/jimd.12020. Epub 2019 Jan 28. PMID: 30693531.
45. Paramasivam A, Venkatapathi C, Sandeep G, Meena AK, Uppin MS, Mohapatra S, Pitceathly RDS, Thangaraj K. Homozygous R627W mutations in POLG cause mitochondrial DNA depletion leading to encephalopathy, seizures and stroke-like episodes. Mitochondrion. 2019 Sep;48:78-83. doi: 10.1016/j.mito.2019.08.003. Epub 2019 Aug 16. PMID: 31425757.
46. McCrea N, Saunders D, Bagkeris E, Chitre M, Ganesan V. Diagnosis of vertebral artery dissection in childhood posterior circulation arterial ischaemic stroke. Dev Med Child Neurol. 2016 Jan;58(1):63-9. doi: 10.1111/dmcn.12945. Epub 2015 Oct 26. PMID: 26502795.
47. Carey S, Wrogemann J, Booth FA, Rafay MF. Epidemiology, Clinical Presentation, and Prognosis of Posterior Circulation Ischemic Stroke in Children. Pediatr Neurol. 2017 Sep;74:41-50. doi: 10.1016/j.pediatrneurol.2017.05.007. Epub 2017 May 19. PMID: 28676245.
48. Ritchey Z, Hollatz AL, Weitzenkamp D, Fenton LZ, Maxwell EC, Bernard TJ, Stence NV. Pediatric cortical vein thrombosis: frequency and association with venous infarction. Stroke. 2016;47:866-868. doi: 10.1161/STROKEAHA.115.011291.
49. Ichord RN, Benedict SL, Chan AK, Kirkham FJ, Nowak-Göttl U; International Paediatric Stroke Study Group. Paediatric cerebral sinovenous thrombosis: findings of the International Paediatric Stroke Study. Arch Dis Child. 2015;100:174-179. doi: 10.1136/archdischild-2014-306382.
50. Suppiej A, Gentilomo C, Saracco P, Sartori S, Agostini M, Bagna R, Bassi B, Giordano P, Grassi M, Guzzetta A, Lasagni D, Luciani M, Molinari AC, Palmieri A, Putti MC, Ramenghi LA, Rota LL, Sperlì D, Laverda AM, Simioni P; Stroke Working Group of the Italian Registry of Pediatric Thrombosis. Paediatric arterial ischaemic stroke and cerebral sinovenous thrombosis: first report from the Italian Registry of Pediatric Thrombosis (R.I.T.I., Registro Italiano Trombosi Infantili). Thromb Haemost. 2015;113:1270-1277. doi: 10.1160/TH14-05-0431.
51. Zanoletti E, Cazzador D, Faccioli C, Sari M, Bovo R, Martini A. Intracranial venous sinus thrombosis as a complication of otitis media in children: critical review of diagnosis and management. Int J Pediatr Otorhinolaryngol. 2015;79:2398-2403. doi: 10.1016/j.ijporl.2015.10.059.
52. Ghanem KM, Dhayni RM, Al-Aridi C, Tarek N, Tamim H, Chan AKC, Saab R, Abboud MR, El-Solh H, Muwakkit SA. Cerebral sinus venous thrombosis during childhood acute lymphoblastic leukemia therapy: risk factors and management [published online October 18, 2017]. Pediatr Blood Cancer. doi: 10.1002/pbc.26694.
53. Petrov D, Uohara MY, Ichord R, Ali Z, Jastrzab L, Lang SS, Billinghurst L. Pediatric cerebral sinovenous thrombosis following cranial surgery. Childs Nerv Syst. 2017;33:491-497. doi: 10.1007/s00381-016-3329-2.
54. Sarikaya H, Steinlin M. Cerebellar stroke in adults and children. Handb Clin Neurol. 2018;155:301-312. doi: 10.1016/B978-0-444-64189-2.00020-2. PMID: 29891068.
55. Mackay MT, Churilov L, Donnan GA, Babl FE, Monagle P. Performance of bedside stroke recognition tools in discriminating childhood stroke from mimics. Neurology. 2016;86:2154-2161. doi: 10.1212/WNL.0000000000002736.
56. Greenham M, Gordon A, Anderson V, Mackay MT. Outcome in Childhood Stroke. Stroke. 2016 Apr;47(4):1159-64. doi: 10.1161/STROKEAHA.115.011622. Epub 2016 Mar 8. PMID: 26956257.
57. Crawford LB, Golomb MR. Childhood Stroke and Vision: A Review of the Literature. Pediatr Neurol. 2018 Apr;81:6-13. doi: 10.1016/j.pediatrneurol.2017.11.007. Epub 2017 Nov 20. PMID: 29526346.
58. Slim M, Fox CK, Friefeld S, Dlamini N, Westmacott R, Moharir M, MacGregor D, deVeber G; SIPS Investigators. Validation of the pediatric stroke outcome measure for classifying overall neurological deficit. Pediatr Res. 2020 Aug;88(2):234-242. doi: 10.1038/s41390-020-0842-5. Epub 2020 Mar 16. PMID: 32179868.
59. Ghotra SK, Johnson JA, Qiu W, Newton AS, Rasmussen C, Yager JY. Health-related quality of life and its determinants in paediatric arterial ischaemic stroke survivors. Arch Dis Child. 2018 Oct;103(10):930-936. doi: 10.1136/archdischild-2017-313334. Epub 2018 Mar 8. PMID: 29519944.
60. Fiume A, Deveber G, Jang SH, Fuller C, Viner S, Friefeld S. Development and validation of the Pediatric Stroke Quality of Life Measure. Dev Med Child Neurol. 2018 Jun;60(6):587-595. doi: 10.1111/dmcn.13684. Epub 2018 Feb 16. PMID: 29451699.