Número atual: 21(3) - Dezembro 2021
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisao
Probióticos e prebióticos na cólica infantil: uma revisão sistemática
Probiotics and prebiotics in infant colic: a systematic review
Laís Helena Valio Simionato; Isabella Gonçalves Grandini Silas; Hamida Abdul Basset Malat; Georgia Oger Garcia; Matheus Alves Alvares; Vera Esteves Vagnozzi Rullo
DOI:10.31365/issn.2595-1769.v21i3p139-149
Faculdade de Ciências Médicas de Santos - UNILUS, Disciplina de Pediatria - Santos - SP - Brasil
Endereço para correspondência:
Recebido em: 03/02/2021
Aprovado em: 24/02/2021
Instituição: Faculdade de Ciências Médicas de Santos
Resumo
INTRODUÇÃO: A cólica infantil é um dos distúrbios de maior incidência nos primeiros quatro meses de vida, afetando cerca de 20% dos lactentes. Ela ainda não possui um tratamento definitivo, apenas medidas de alívio dos sintomas.
OBJETIVO: Esta revisão visa avaliar os ensaios clínicos randomizados presentes na literatura, quanto à utilização dos probióticos e prebióticos na cólica infantil em lactentes. Fontes de dados: A revisão sistemática se deu através da seleção de artigos no Sistema Online de Busca e Análise de Literatura Médica (MEDLINE), via Pubmed e Scielo.
SÍNTESE DOS DADOS: Dois desfechos se destacaram: a duração do choro diário e incidência de cólica. Foram selecionados 23 estudos, dos quais 13 avaliaram a duração do choro diário, demonstrando redução estatisticamente relevante em relação ao grupo controle; e cinco avaliaram a incidência de cólica, observando igualmente redução significativa no grupo experimental.
CONCLUSÃO: O Lactobacillus reuteri DSM 17938 destaca-se em relação aos demais métodos testados quanto ao manejo clínico da cólica infantil, com redução do tempo de choro, incidência de cólica e demais desfechos. As fórmulas especializadas (como as hidrolisadas ou fermentadas) são consideradas a segunda melhor intervenção disponível. As demais intervenções não demonstram sucesso na literatura, embora o tenham feito neste trabalho, e carecem de maiores estudos acerca de sua aplicabilidade.
Palavras-chave: Pediatria. Cólica. Neonatologia
Abstract
INTRODUCTION: Infantile colic is one of the disorders with the highest incidence in the first four months of life, affecting about 20% of infants. It still does not have a definitive treatment, only measures to relieve symptoms.
OBJECTIVE: This review aims to assess randomized controlled trials in the present literature about the impact of the use of probiotics and prebiotics in management of infant colic. Data source: The systematic review was conducted based on literature search in the "Medical Literature Analysis and Retrieval System Online" (MEDLINE), through Pubmed and Scielo basis.
DATA SYNTHESIS: Two main results were assessed, crying time (main outcome) and incidence of colic (second main outcome). Were included 23 trials, which 13 analysed the main outcome, resulting in significant statistical reduction in comparison with the group control; and five analysed the second main outcome, also obtaining a significant statistical reduction in the incidence of colic in the experimental group.
CONCLUSION: Lactobacilus reuteri DSM 17938 stands out from the other interventions tested in relation to clinical management in infant colic, showing a reduction in crying time, in incidence of colic and in other secondary outcomes. Infant formulas (such as hydrolized and fermented formulas) are considered the second best option available. The other interventions available were not successful in the clinical management in infant colic according to the literature, even though they have showed such sucess in this paper, and lack further studies on this matter.
Keywords: Pediatrics. Colic. Neonatology.
INTRODUÇÃO
A cólica infantil (CI) é uma desordem autolimitante que tem início nas primeiras 2-4 semanas de vida, com maior intensidade dos sintomas entre 4-6 semanas, que diminuem pouco a partir das 12 semanas de vida. É um dos distúrbios de maior incidência nos primeiros quatromeses de vida, afetando cerca de 20% dos lactentes, variando de 3-28%1,2. Os critérios diagnósticos da cólica infantil, estabelecidos pelo Roma IV, são: 1) Início e fim dos sintomas antes dos cinco meses de idade; 2) Episódios recorrentes e prolongados de choro, desconforto ou irritabilidade, referido pelos cuidadores, que ocorrem sem causa aparente e não podem ser prevenidos nem resolvidos por eles; 3) Ausência de qualquer evidência de deficiência de crescimento, febre ou outras doenças.
Para fins de investigação da cólica infantil, o quadro clínico deverá cumprir os critérios diagnósticos prévios e, além disso, incluir os seguintes: 1) O tempo de choro relatado pelos cuidadores deverá ser de três ou mais horas diárias por três ou mais dias da semana; 2) Deverá apresentar uma duração confirmada de três ou mais horas de choro quando for realizado um diário comportamental prospectivo de 24 horas3.
São relatados alguns comportamentos associados à cólica do lactente - choro prolongado ou inconsolável, expressão facial de dor, distensão abdominal, aumento de gases, eritema corporal e flexão de pernas no abdome - que não são indicativos de enfermidade orgânica. A comprovação de que manobras calmantes como massagem ou balanço rítmico em um ambiente calmo tranquilizam o lactente, e assim que cessadas o choro retorna, apoia o diagnóstico3.
Diversas hipóteses dos mecanismos envolvidos no desenvolvimento da cólica infantil já foram aventadas, como a intolerância à lactose, a hipersensibilidade alimentar, alergias desencadeadas pela exposição à proteína do leite de vaca, à fórmula infantil ou ao leite materno2 e as dificuldades na alimentação do lactente, entre outras2,4,5. Somando-se às hipóteses já citadas, a alteração da microbiota intestinal constitui um dos possíveis fatores causais da patologia. Essa hipótese pode ser explicada pelo fato de os lactentes com cólica infantil terem em seu intestino maiores concentrações de microrganismos formadores de gases, como E. coli, e uma diminuição de colônias de Lactobacillus spp e Bifidobacterium spp, além de hipermotilidade intestinal6,7,8. A colonização por Bifidobacterium e Lactobacillus levaria a maior produção de ácidos orgânicos como acético e lático, com consequente diminuição do pH intraluminal, que inibe o crescimento de microorganismos patogênicos. Ademais, elas competem com bactérias potencialmente patogênicas por sítios de adesão epitelial e nutrientes9. Também foi observado que os lactentes com CI têm maior concentração de calprotectina, um marcador de inflamação intestinal.4
Atualmente, as opções de tratamento da CI são de suporte e de alívio dos sintomas, por meio da utilização de drogas como simeticona, dicicloverina e cimetrópio. Estas duas últimas não são consideradas de primeira escolha devido aos efeitos apneico e sedativo, respectivamente.8 O uso de fórmulas hipoalergênicas e a eliminação da proteína do leite de vaca da dieta materna são métodos alternativos, embora sem eficácia comprovada e resposta parcial na CI4.
Tendo em vista os possíveis fatores causais da doença e a busca por um tratamento definitivo, nos últimos anos há cada vez mais estudos sobre o uso de prebióticos e probióticos na cólica infantil. Prebióticos são componentes alimentares não digeríveis com capacidade de estimular seletivamente a proliferação ou atividade de populações de bactérias desejáveis no cólon, além de inibir a multiplicação de patógenos10,11,12,13. Os probióticos são microorganismos vivos que, quando administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro através da sua flora intestinal, sendo Lactobacillus e Bifidobacterium os mais comumente usados entre os pacientes pediátricos8,14,15,16. Logo, o uso desses produtos visa equilibrar a microbiota, reduzir a inflamação intestinal e as bactérias formadoras de gases, além de diminuir o inchaço e a dismotilidade intestinal e aumentar a barreira mucosa6,17.
Esta revisão sistemática visa reunir informações acerca de possíveis benefícios do uso de probióticos e prebióticos na cólica infantil. A média de duração do choro diário é o desfecho principal que este estudo busca analisar. Outros desfechos também analisados por este estudo foram: a incidência de cólica, a redução do tempo de choro diário, a média de ligações ao pediatra devido à cólica, o tempo total de choro durante o período do estudo e a incidência de irritabilidade ou agitação sem choro.
METODOLOGIA
Trata-se de estudo de revisão sistemática de literatura baseado no Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA), sendo a busca dos estudos realizada nas bases de dados Sistema Online de Busca e Análise de Literatura Médica (MEDLINE), via PubMed e Scielo.
Para a base MEDLINE, foram utilizados os descritores apenas em inglês "probiotics", "prebiotics", "lactobacillus", "bifidobacterium", "Randomized Controlled Trial", "infant", "child", "adolescent", "newborn" e "preschool" da Medical Subject Headings (MeSH), por meio da seguinte associação com os operadores boleanos OR e AND: "probiotics" OR "prebiotics" OR "lactobacillus" OR "bifidobacterium" AND "Randomized Controlled Trial" AND "infant" OR "child" OR "adolescent" OR "newborn" OR "preschool" AND "colic". Para a base Scielo, foram utilizados os descritores "probiotics", "prebiotics", "infant" e "colic", por meio da seguinte associação com os operadores boleanos OR e AND: (infant) AND (colic) AND (prebiotics) OR (probiotics).
Esta revisão foi realizada em julho de 2020 e teve como critérios de inclusão ensaios clínicos randomizados contendo em seus títulos as palavras-chave "infant", "colic" e "prebiotics" ou "probiotics", sem restrição quanto ao idioma e ano de publicação. Quanto aos critérios de exclusão, foram descartados os artigos de relatos de caso, coortes, estudos transversais e casos-controle; artigos que extrapolam a relação cólica infantil versus intervenção desejada; e aqueles que extrapolam o grupo de estudo alvo (lactentes), como gestantes ou parturientes. Posteriormente, os textos foram analisados integralmente, sendo incluídos por definitivo aqueles cujo objetivo era relacionar o uso de probióticos ou prebióticos na cólica infantil, nos aspectos de prevenção, tratamento e alteração da microbiota intestinal. Quanto aos artigos excluídos após a leitura integral, um não abordava o tema proposto nos aspectos citados18. Outro relacionou grupo de colonizados pelo probiótico proposto versus não colonizados, independentemente da utilização ou não do probiótico e, portanto, prejudicando a análise de efetividade do probiótico na cólica7. Por último, outro apenas demonstra protocolo do modelo de estudo como etapa inicial de um ensaio clínico17. O processo de seleção, inclusão e exclusão dos artigos está descrito no fluxograma 1.
RESULTADOS
As pesquisas bibliográficas nas bases de dados Scielo e PubMed identificaram 63 artigos. Com base nos critérios de exclusão citados em "métodos", foram excluídos 37 artigos pela leitura do seu título e resumo. Os demais foram avaliados para elegibilidade por meio da leitura do texto completo e três artigos foram excluídos. Portanto, após a triagem metodológica, 23 estudos foram incluídos nesta revisão sistemática. O fluxograma 1 descreve as etapas para seleção e inclusão dos artigos.
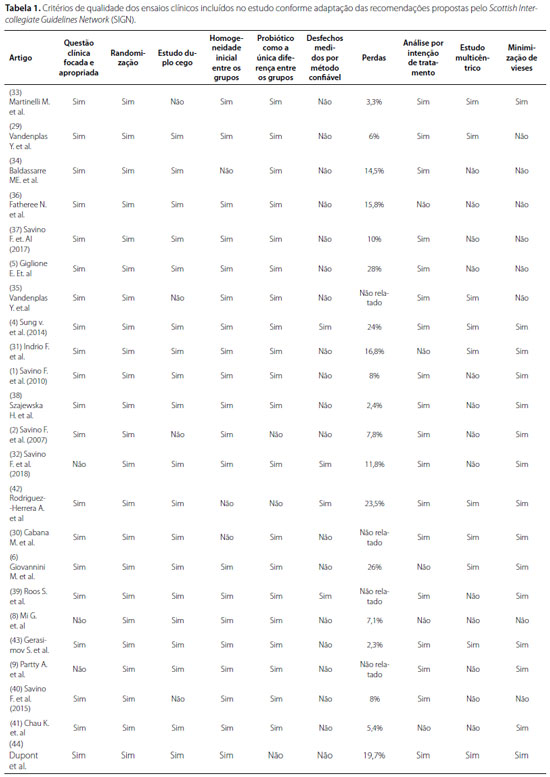
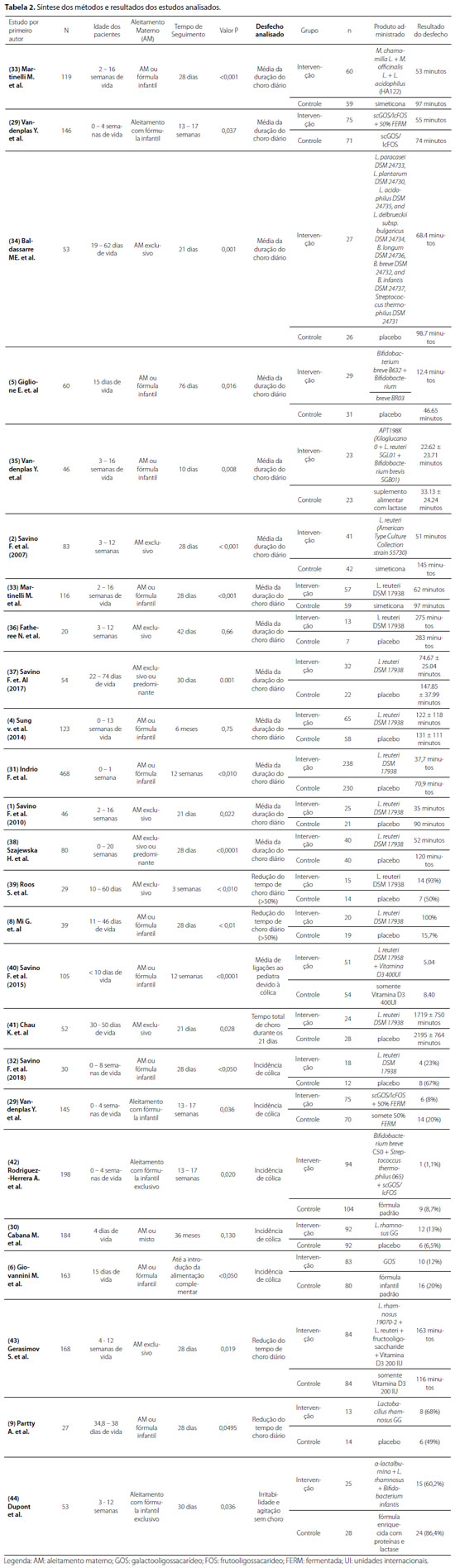
Todos os artigos incluídos eram ensaios clínicos randomizados, e seus critérios de qualidade foram adaptados das recomendações propostas pela Scottish Intercollegiate Guidelines Network (SIGN), como pode ser observado na tabela 119. Vinte e três estudos foram analisados de acordo com intervenção e desfecho, idade dos participantes, tempo de seguimento e tamanho da população estudada, conforme a tabela 2, que resume as características de todas as publicações incluídas. Os estudos foram realizados nos seguintes países: Ucrânia, Itália, França, Bélgica, Irlanda, Finlândia, EUA, Canadá, Espanha, Polônia, Austrália e China. No total, foram avaliados 2.611 pacientes, entre 0-20 semanas de vida, cujo tempo de seguimento variou de 10 dias a 36 meses (tabela 2).
Nos artigos incluídos nesta revisão sistemática, oito desfechos foram reportados: média da duração do choro diário, redução do tempo de choro ou irritabilidade, incidência de cólica, média de ligações ao pediatra devido à cólica, tempo total de choro durante o período do estudo, irritabilidade ou irritação sem choro e o número de lactentes que reduziram o tempo de choro em pelo menos 50%. A média de duração do choro diário é o objetivo principal de análise desta revisão, e os demais desfechos citados acima foram analisados como resultados secundários (tabela 2).
A média da duração do choro diário foi o desfecho mais estudado pelos artigos incluídos, sendo analisado por 13 artigos, dos quais 11 encontraram redução estatisticamente significativa (IC = 95%, P < 0,05) desse valor, entre os pacientes que recebiam prebióticos ou probióticos, quando comparados ao grupo controle. Os estudos de Fatheree et al.36 e Sung et al. também observaram redução da duração de choro diário no grupo que recebeu a intervenção, mas não foi estatisticamente significativo (P > 0,05).
Como outros resultados aqui analisados, verifica-se que a incidência de cólica foi o segundo desfecho mais estudado, sendo analisada por cinco artigos. Dentre eles, quatro encontraram redução significativa na incidência de cólica no grupo que estava recebendo a intervenção (IC = 95%, P < 0,05). O estudo de Cabana et al.30 foi o único a encontrar um desfecho menos favorável no grupo que recebeu a intervenção, sendo reportado aumento na incidência de cólica neste grupo, embora não tenha sido estatisticamente relevante (P > 0,05).
Embora a redução do tempo de choro diário em pelo menos 50% tenha sido estudada por apenas dois artigos, ambos encontraram o aumento deste desfecho no grupo que estava recebendo probióticos ou prebióticos (IC < 95%, P > 0,05). Outro desfecho estudado por somente dois ensaios foi a redução do tempo de choro diário, sendo que ambos encontraram redução significativa deste tempo entre os pacientes pertencentes ao grupo que recebeu a intervenção (IC = 95%, P < 0,05).
Os desfechos menos analisados foram a média de ligações ao pediatra devido à cólica, o tempo total de choro durante o período do estudo e a incidência de irritabilidade ou agitação sem choro; ainda assim, todos encontraram redução significativa dos desfechos entre os pacientes que estavam recebendo probióticos ou prebióticos, quando comparados ao grupo controle (IC = 95%, P < 0,05).
Dentre os artigos analisados por esta revisão sistemática, se destaca em frequência o uso de L. reuteri DSM 17938 como probiótico. Cinco dos sete estudos que utilizaram a cepa L. reuteri DSM 17938 como probiótico no grupo intervenção, para avaliar a média da duração do choro diário em comparação ao grupo controle, obtiveram resultados favoráveis ao grupo intervenção (IC = 95%, P < 0,05). Os outros dois estudos, Fatheree et al.36 e Sung v. et al. (2014), também resultaram em menor média da duração do choro diário para o grupo que recebeu a intervenção, entretanto, sem um valor estatisticamente significativo (P > 0,05). Outros cinco estudos avaliaram a resposta ao L. reuteri DSM 17938 e tiveram, em comparação aos grupos-controle, como resultados nessa intervenção: dois estudos com maior porcentagem de lactentes que reduziram o tempo de choro em pelo menos 50%, menor média de ligações ao pediatra devido à cólica, menor tempo total de choro durante o estudo e menor incidência de cólica.
Outra cepa que se repete nos estudos é a L. rhamnosus GG, tendo sido usada nos estudos de Cabana et al.30 e Partty et al. em comparação a grupos que receberam placebo. No estudo de Cabana M et al., o grupo que recebeu o probiótico apresentou maior incidência de cólica, mas não de modo estatisticamente significante (P > 0,05). Por sua vez, no estudo de Partty et al., houve redução do tempo de choro diário nos pacientes submetidos à ingestão deste probiótico (IC = 95%, P < 0,05). As demais cepas utilizadas pelos estudos não se repetem entre eles.
Em relação aos prebióticos, o estudo de Vandenplas et al. demonstrou melhor resultado para os lactentes que receberam fórmula fermentada com scGOS/lcFOS ao invés de apenas fórmula 50% fermentada - o primeiro grupo apresentou menor incidência de cólica (IC = 95%, P < 0,05). Por outro lado, a combinação scGOS/lcFOS + 50% FERM também se mostrou mais favorável do que apenas a administração do prebiótico scGOS/lcFOS isoladamente, pois a primeira levou à menor média da duração do choro diário (IC = 95%, P < 0,05). O estudo de Giovannini et al.6 apresentou menor incidência de cólica no grupo que recebeu o prebiótico GOS em comparação ao grupo que estava apenas com fórmula infantil padrão (IC = 95%, P < 0,05). Outros quatro estudos - Vandenplas et al.35, Rodriguez-Herrera et al.42, Gerasimov et al.43 e Dupont et al.44 - também utilizaram prebióticos, porém combinados a probióticos, e todos obtiveram melhor resultado para o grupo que recebeu a intervenção (IC = 95%, P < 0,05), conforme detalhado na tabela 2. O estudo de Rodriguez-Herrera et al.42 utilizou o mesmo prebiótico scGOS/ lcFOS que o trabalho de Vandenplas et al. Já citado; os outros três estudos utilizaram prebióticos diversos.
DISCUSSÃO
Esta revisão complementa a literatura acerca do manejo da CI, por abranger uma análise mais ampla do tratamento e prevenção da patologia com enfoque na eficácia de diferentes probióticos e prebióticos.
A média da duração do choro diário é o mesmo desfecho abordado pela maioria das revisões sistemáticas e encontra-se em concordância com a literatura sobre o tema. Da mesma forma, o L. reuteri, em especial a cepa DSM 17938, é o probiótico mais estudado e com melhores desfechos no tratamento da CI. Os períodos predeterminados para avaliação da intervenção variam dentre os ensaios clínicos, mas, no geral, ocorrem em 7, 14, 21 e 28 dias de uso do probiótico ou placebo. Foi observado, pela maioria dos autores desta revisão e de revisões prévias, que a melhor resposta aos sintomas da cólica parece se mostrar próximo ao fim da intervenção (ao longo de 21, 28 ou 30 dias, por exemplo).20-25 De acordo com o Consenso de Experts Latino-americanos em Pediatria (2015), o L. reuteri DSM 17938 tem nível de evidência 1b para o tratamento da CI26.
Ainda é de concordância ampla na literatura a eficácia do L. reuteri nos lactentes com CI sob amamentação exclusiva ou predominante, fato que não pode ser demonstrado no grupo em uso de fórmula infantil, ainda que isto não tenha sido demonstrado nesta revisão. É possível que tal divergência seja causada pela diferença da composição da flora intestinal em ambos os grupos20,22,23,24,27,28. Em análise dos resultados desta revisão, outros agentes demonstraram aplicabilidade na diminuição da duração de choro, como o Bifidobacterium breve, com resultados promissores na prevenção da CI. Um estudo demonstrou a eficácia de duas cepas do B. breve, em conjunto, quando comparadas ao placebo; contudo, demais estudos cuja composição da intervenção contemplam o B. breve também possuem prebióticos e/ou outros probióticos, como o próprio L. reuteri. Este fato dificulta a análise comparativa dos estudos entre si, tanto com relação à eficácia do B. breve, quanto de outros agentes5.
A incidência de cólica foi o segundo desfecho mais estudado pelos artigos incluídos, sendo analisada por cinco destes. Uma das intervenções utilizada nos ensaios clínicos que avaliaram esse desfecho foi o uso de prebióticos fruto-oligossacarídeos (FOS) e galacto-oligossacarídeos (GOS), com diminuição da incidência de cólica em relação à fórmula infantil parcialmente fermentada e possível superioridade do GOS em relação à fórmula infantil padrão6,29. Atualmente, segundo as evidências científicas disponíveis, as fórmulas especializadas (como as hidrolisadas ou fermentadas) são consideradas a segunda melhor intervenção para a CI disponível21. Ainda quanto ao desfecho de incidência de cólica, o L. reuteri, apresentou novamente resultados positivos, assim como nos demais desfechos: redução de tempo de choro diário, tempo total de choro durante 21 dias e menos ligações ao pediatra. Já o L. rhamnosus GG não obteve eficácia na prevenção da cólica, mas quando avaliado quanto ao tempo de choro diário nos lactentes com CI, houve redução em comparação ao placebo27,30. As demais intervenções, que contêm fórmulas infantis enriquecidas, probióticos e prebióticos, embora tenham apresentado desfecho positivo em relação aos sintomas de cólica, não são aplicáveis para comparação devido carência de outros ensaios clínicos e de revisões prévias que determinem sua eficácia.
Os estudos incluídos nesta revisão sistemática apresentam limitações, e a principal, por ter sido mais vezes citada, trata da falta de um método objetivo e claro para medir a ocorrência de episódios de CI durante o tratamento. Os pesquisadores obtiveram esses dados a partir do relato dos pais sobre a ocorrência e duração dos episódios de CI. Outra limitação encontrada em alguns estudos foi a seleção de pacientes. Um dos trabalhos relatou recrutamento de uma população geral, sem realizar nenhum tipo de seleção, ao invés de lactentes com diagnóstico de CI, o que também agrega o risco de tratar pacientes sem doença31. Estudos que recrutaram lactentes em aleitamento materno exclusivo e que excluíram pacientes com chance de alergia à proteína do leite da vaca também podem gerar uma população não tão representativa.
CONCLUSÃO
O Lactobacillus reuteri DSM 17938 destaca-se em relação aos demais métodos testados quanto ao manejo clínico da cólica infantil, com relação ao tempo de choro, incidência de cólica e demais desfechos secundários. É de concordância na literatura que o aleitamento materno exclusivo ou predominante é importante para a eficácia deste probiótico.
As fórmulas especializadas (como as hidrolisadas ou fermentadas) são consideradas a segunda melhor intervenção disponível. As demais, sobretudo o Lactobacillus rhamnosus, FOS, GOS, fórmulas suplementadas e Bifidobacterium breve, individualmente, não demonstraram sucesso na literatura, embora tenham tido resultados favoráveis nesta revisão. Assim, carecem de maiores estudos acerca de sua aplicabilidade.
Agradecimentos
Dedicamos este artigo a nossos pais e familiares, que nos apoiaram durante todo o processo de construção. Agradecemos também aos nossos professores e amigos que nos incentivaram a produção científica. Por fim, agradecemos imensamente ao nosso professor e orientador M. (oculto para submissão para a revista) que se fez disponível integralmente, sempre visando ao melhor para nosso trabalho.
REFERÊNCIAS
1. Savino F, Cordisco L, Tarasco V, Palumeri E, Calabrese R, Oggero R, et al. Lactobacillus reuteri DSM 17938 in infantile colic: a randomized, double-blind, placebo-controlled trial. Pediatrics. 2010;126(3):e526-533. https://pediatrics.aappublications.org/content/126/3/e526. Acesso: 01/08/2020.
2. Savino F, Pelle E, Palumeri E, Oggero R, Miniero R. Lactobacillus reuteri (American Type Culture Collection Strain 55730) versus simethicone in the treatment of infantile colic: a prospective randomized study. Pediatrics. 2007;119(1):e124-130. https://pediatrics.aappublications.org/content/119/1/e124. Acesso: 01/08/2020.
3. Blesa Baviera LC. Trastornos digestivos funcionales pediátricos. Criterios Roma IV. In: AEPap (ed.). Curso de Actualización Pediatría 2017. Madrid: Lúa Ediciones 3.0; 2017. p. 99-114.
4. Sung V, Hiscock H, Tang ML, Mensah FK, Nation ML, Satzke C, et al. Treating infant colic with the probiotic Lactobacillus reuteri: double blind, placebo controlled randomised trial. BMJ. 2014;348:g2107. https://www.bmj.com/content/348/bmj.g2107. Acesso: 01/08/2020.
5. Giglione E, Prodam F, Bellone S, Monticone S, Beux S, Marolda A, et al. The Association of Bifidobacterium breve BR03 and B632 is Effective to Prevent Colics in Bottle-fed Infants: A Pilot, Controlled, Randomized, and Double-Blind Study. J Clin Gastroenterol. 2015;5(2):164-167. https://journals.lww.com/jcge/Fulltext/2016/11001/The_Association_of_Bifidobacterium_breve_BR03_and.17.aspx. Acesso: 01/08/2020.
6. Giovannini M, Verduci E, Gregori D, Ballali S, Soldi S, Ghisleni D, et al. Prebiotic effect of an infant formula supplemented with galacto-oligosaccharides: randomized multicenter trial. J Am Coll Nutr. 2014;33(5):385-393. https://www.tandfonline.com/doi/abs/10.1080/07315724.2013.878232. Acesso: 01/08/2020.
7. Nation ML, Dunne EM, Joseph SJ, Mensah FK, Sung V, Satzke C, et al. Impact of Lactobacillus reuteri colonization on gut microbiota, inflammation, and crying time in infant colic. Sci Rep. 2017;7(1):15047. https://www.nature.com/articles/s41598-017-15404-7. Acesso: 01/08/2020.
8. Mi GL, Zhao L, Qiao DD, Kang WQ, Tang MQ, Xu JK. Effectiveness of Lactobacillus reuteri in infantile colic and colicky induced maternal depression: a prospective single blind randomized trial. Antonie Van Leeuwenhoek. 2015;107(6):1547-1553. https://link.springer.com/article/10.1007/s10482-015-0448-9. Acesso: 10/08/2020.
9. Pärtty A, Lehtonen L, Kalliomäki M, Salminen S, Isolauri E. Probiotic Lactobacillus rhamnosus GG therapy and microbiological programming in infantile colic: a randomized, controlled trial. Pediatr Res. 2015;78(4):470-475. https://www.nature.com/articles/pr2015127. Acesso: 01/08/2020.
10. Roberfroid, MB. Prebiotics: preferential substrates for specific germs? Am. J. Clin. Nutr. 2001; 73 (2):406-409. https://academic.oup.com/ajcn/article/73/2/406s/4737570. Acesso: 10/08/2020.
11. Gilliland SE. Probiotics and prebiotics. In: Marth EH, Steele JL, eds. Applied Dairy Microbiology. New York: Marcel Dekker; 2001. p.327-343.
12. Mattila-Sandholm T, Myllärinen P, Crittenden R, Mogensen G, Fondén R, Saarela M. Technological challenges for future probiotic foods. Int. Dairy J. 2002; 12(2):173-182. https://europepmc.org/article/agr/ind23320686. Acesso: 10/08/2020.
13. Report of a Joint of Food and Agriculture Organization of the United Nations/World Health Organization Expert Consultation on Evaluation of Health and Nutrition Properties of Probiotics in Food including Powder Milk with Live Lactic Acid Bacteria. Probiotics in food - Health and Nutritional Properties and Guidelines for Evaluation. 2001, Córdoba, Argentina. [S. l.: s. n.], 2001. http://www.fao.org/3/a-a0512e.pdf. Acesso: 01/08/2020.
14. Who.int [site na internet]. New York: World Health Organization, Inc. https://www.who.int/. Acesso: 10/08/2020.
15. Sanders, ME. Probiotics: considerations for human health. Nutr. Rev. 2003; 61(3): 91-99. https://academic.oup.com/nutritionreviews/article/61/3/91/1865418. Acesso: 10/08/2020.
16. Puupponen-Pimiä R, Aura AM, Oksman-Caldentey KM, Myllärinen P, Saarela M, Mattila-Sanholm T, et al. Development of functional ingredients for gut health. Trends Food Sci. Technol. 2002; 13(1):3-11. https://www.sciencedirect.com/science/article/abs/pii/S0924224402000201?via%3Dihub Acesso: 10/08/2020.
17. Sung V, Hiscock H, Tang M, Mensah FK, Heine RG, Stock A, et al. Probiotics to improve outcomes of colic in the community: protocol for the Baby Biotics randomised controlled trial. BMC Pediatr. 2012;135(12). https://bmcpediatr.biomedcentral.com/articles/10.1186/1471-2431-12-135. Acesso: 01/08/2020.
18. Vivatvakin B, Mahayosnond A, Theamboonlers A, Steenhout PG, Conus NJ. Effect of a whey-predominant starter formula containing LCPUFAs and oligosaccharides (FOS/GOS) on gastrointestinal comfort in infants. Asia Pac J Clin Nutr. 2010;19(4):473-480. https://pubmed.ncbi.nlm.nih.gov/21147707/. Acesso: 01/08/2020.
19. Scottish Intercollegiate Guidelines Network. SIGN 50. A Guideline Developers' Handbook. Edinburgh, February 2001.
20. Ellwood J, Draper-Rodi J, Carnes D. Comparison of common interventions for the treatment of infantile colic: a systematic review of reviews and guidelines. BMJ Open. 2020;10(2):e035405. https://bmjopen.bmj.com/content/10/2/e035405. Acesso: 15/09/2020.
21. Gutiérrez-Castrellón P, Indrio F, Bolio-Galvis A, Jiménez-Gutiérrez C, Jimenez-Escobar I, López-Velázquez G. Efficacy of Lactobacillus reuteri DSM 17938 for infantile colic: Systematic review with network meta-analysis. Medicine. 2018; 96(51): e9375. https://journals.lww.com/md-. Acesso: 15/09/2020.
22. Sung V, D'Amico F, Cabana MD, Chau K, Koren G, Savino F, Szajewska H, et al. Lactobacillus reuteri to Treat Infant Colic: A Meta-analysis. Pediatrics. 2018;141(1):e20171811. https://pediatrics.aappublications.org/content/141/1/e20171811. Acesso: 15/09/2020.
23. Hjern A, Lindblom K, Reuter A, Silfverdal SA. A systematic review of prevention and treatment of infantile colic. Acta Paediatr. 2020;109(9):1733-1744. https://onlinelibrary.wiley.com/doi/full/10.1111/apa.15247. Acesso: 15/09/2020.
24. Sung V. Probiotic interventions in infantile colic. Curr Opin Clin Nutr Metabol Care. 2015;18(3):307-311.https://journals.lww.com/co-clinicalnutrition/Abstract/2015/05000/Probiotic_interventions_in_infantile_colic.16.aspx. Acesso: 15/09/2020.
25. Moreira AC, Castro JC, Barreira JF, Coimbra R. Tratamento da cólica infantil: uma revisão baseada na evidência. Rev Port Med Geral Fam. 2019;35(5):367-380. http://www.scielo.mec.pt/scielo.php?script=sci_arttext&pid=S2182-51732019000500004&lng=pt. Acesso: 15/09/2020.
26. Cruchet S, Furnes R, Maruy A, Hebel E, Palacios J, Medina F, et al. The use of probiotics in pediatric gastroenterology: a review of the literature and recommendations by Latin-American experts. Paediatr Drugs. 2015;17(3):199-216. https://link.springer.com/article/10.1007%2Fs40272-015-0124-6. Acesso: 15/09/2020.
27. Pärtty A, Rautava S, Kalliomäki M. Probiotics on Pediatric Functional Gastrointestinal Disorders. Nutrients. 2018;10(12):1836. https://www.mdpi.com/2072-6643/10/12/1836. Acesso: 15/09/2020.
28. Karkhaneh M, Fraser L, Jou H, Vohra S. Effectiveness of probiotics in infantile colic: A rapid review. Paediatr Child Health. 2020;25(3):149-159. https://academic.oup.com/pch/article-abstract/25/3/149/5426479?redirectedFrom=fulltext. Acesso: 15/09/2020.
29. Vandenplas Y, Ludwig T, Bouritius H, Alliet P, Forde D, Peeters S, et al. Randomised controlled trial demonstrates that fermented infant formula with short-chain galacto-oligosaccharides and long-chain fructo-oligosaccharides reduces the incidence of infantile colic. Acta Paediatr. 2017;106(7):1150-1158. https://onlinelibrary.wiley.com/doi/full/10.1111/apa.13844. Acesso: 15/09/2020.
30. Cabana MD, McKean M, Beck AL, Flaherman V. Pilot Analysis of Early Lactobacillus rhamnosus GG for Infant Colic Prevention. J Pediatr Gastroenterol Nutr. 2019;68(1):17-19. https://journals.lww.com/jpgn/Fulltext/2019/01000/Pilot_Analysis_of_Early_Lactobacillus_rhamnosus_GG.5.aspx. Acesso: 10/08/2020.
31. Indrio F, Di Mauro A, Riezzo G, Civardi E, Intini C, Corvaglia L et al. Prophylactic use of a probiotic in the prevention of colic, regurgitation, and functional constipation: a randomized clinical trial. JAMA Pediatr. 2014;168(3):228-233. https://jamanetwork.com/journals/jamapediatrics/fullarticle/1812293. Acesso: 10/08/2020.
32. Savino F, Galliano I, Garro M, Savino A, Daprà V, Montanari P, et al. Regulatory T cells and Toll-like receptor 2 and 4 mRNA expression in infants with colic treated with Lactobacillus reuteri DSM17938. Benef Microbes. 2018;9(6):917-925. https://www.wageningenacademic.com/doi/10.3920/BM2017.0194. Acesso: 10/08/2020.
33. Martinelli M, Ummarino D, Giugliano FP, Sciorio E, Tortora C, Bruzzese D et al. Efficacy of a standardized extract of Matricariae chamomilla L., Melissa officinalis L. and tyndallized Lactobacillus acidophilus (HA122) in infantile colic: An open randomized controlled trial. Neurogastroenterol Motil. 2017;29(12)e13145. https://onlinelibrary.wiley.com/doi/abs/10.1111/nmo.13145. Acesso: 10/08/2020.
34. Baldassarre ME, Di Mauro A, Tafuri S, Rizzo V, Gallone MS, Mastromarino P et al. Effectiveness and Safety of a Probiotic-Mixture for the Treatment of Infantile Colic: A Double-Blind, Randomized, Placebo-Controlled Clinical Trial with Fecal Real-Time PCR and NMR-Based Metabolomics Analysis. Nutrients. 2018;10(2):195. https://www.mdpi.com/2072-6643/10/2/195. Acesso: 10/08/2020.
35. Vandenplas Y, Bacarea A, Marusteri M, Bacarea V, Constantin M, Manolache M. Efficacy and safety of APT198K for the treatment of infantile colic: a pilot study. J Comp Eff Res. 2017;6(2):137-144. https://www.futuremedicine.com/doi/10.2217/cer-2016-0059. Acesso: 10/08/2020.
36. Fatheree NY, Liu Y, Taylor CM, Hoang TK, Cai C, Rahbar MH et al. Lactobacillus reuteri for Infants with Colic: A Double-Blind, Placebo-Controlled, Randomized Clinical Trial. J Pediatr. 2017;191:170-178. https://www.jpeds.com/article/S0022-3476(17)31039-9/fulltext. Acesso: 10/08/2020.
37. Savino F, Garro M, Montanari P, Galliano I, Bergallo M. Crying Time and RORγ/FOXP3 Expression in Lactobacillus reuteri DSM17938-Treated Infants with Colic: A Randomized Trial. J Pediatr. 2018;192:171-177. https://www.jpeds.com/article/S0022-3476(17)31143-5/fulltext. Acesso: 10/08/2020.
38. Szajewska H, Gyrczuk E, Horvath A. Lactobacillus reuteri DSM 17938 for the management of infantile colic in breastfed infants: a randomized, double-blind, placebo-controlled trial. J Pediatr. 2013;162(2):257-262. https://www.jpeds.com/article/S0022-3476(12)00920-1/fulltext. Acesso: 10/08/2020.
39. Roos S, Dicksved J, Tarasco V, Locatelli E, Ricceri F, Grandin U et al. 454 pyrosequencing analysis on faecal samples from a randomized DBPC trial of colicky infants treated with Lactobacillus reuteri DSM 17938. PLoS ONE. 2013;8(2):e56710. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0056710. Acesso: 10/08/2020.
40. Savino F, Ceratto S, Poggi E, Cartosio ME, Cordero di Montezemolo L, Giannattasio A. Preventive effects of oral probiotic on infantile colic: a prospective, randomised, blinded, controlled trial using Lactobacillus reuteri DSM 17938. Benef Microbes. 2015;6(3):245-251. https://www.wageningenacademic.com/doi/10.3920/BM2014.0090. Acesso: 10/08/2020.
41. Chau K, Lau E, Greenberg S, Jacobson S, Yazdani-Brojeni P, Verma N et al. Probiotics for infantile colic: a randomized, double-blind, placebo-controlled trial investigating Lactobacillus reuteri DSM 17938. J Pediatr. 2015;166(1):74-78. https://www.jpeds.com/article/S0022-3476(14)00848-8/fulltext. Acesso: 10/08/2020.
42. Rodriguez-Herrera A, Mulder K, Bouritius H, Rubio R, Muñoz A, Agosti M et al. Gastrointestinal Tolerance, Growth and Safety of a Partly Fermented Formula with Specific Prebiotics in Healthy Infants: A Double-Blind, Randomized, Controlled Trial. Nutrients. 2019;11(7):1530. https://www.mdpi.com/2072-6643/11/7/1530. Acesso: 10/08/2020.
43. Gerasimov S, Gantzel J, Dementieva N, Schevchenko O, Tsitsura O, Guta N et al. Role of Lactobacillus rhamnosus (FloraActiveT) 19070-2 and Lactobacillus reuteri (FloraActiveT) 12246 in Infant Colic: A Randomized Dietary Study. Nutrients. 2018;10(12):1975. https://www.mdpi.com/2072-6643/10/12/1975. Acesso: 10/08/2020.
44. Dupont C, Rivero M, Grillon C, Belaroussi N, Kalindjian A, Marin V. Alpha-lactalbumin-enriched and probiotic-supplemented infant formula in infants with colic: growth and gastrointestinal tolerance. Eur J Clin Nutr. 2010;64(7):765-767. https://www.nature.com/articles/ejcn201081. Acesso: 10/08/2020.