Número atual: 16(1) - Fevereiro 2016
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
RELATOS DE CASO
Síndrome de Mauriac em criança com diabetes mellitus do tipo 1 e controle glicêmico inadequado
Mauriac Syndrome in a child with type 1 diabetes mellitus and inappropriate glycemic control
Gabrielle Macedo Pedrosa1; Eduardo Machado Gaiane1; Rafaella Maia Paredes2; Laura Gonçalves Machado2; Cléo Bragança Cardoso3; Danielle Plubins Bulkool4
1. Estudante de Medicina da Universidade Federal Fluminense
2. Médica da Universidade Federal Fluminense
3. Residente de Pediatria da Universidade Federal Fluminense
4. Mestrado em Pediatria com área de concentração em Gastroenterologia Pediátrica pela Universidade Federal Fluminense - Professora assistente 1 da Universidade Federal Fluminense
Endereço para correspondência:
Rua Dr. Paulo César, 203, apto 603, Santa Rosa
Niterói, RJ
E-mail: gabimacedoped@yahoo.com.br
Instituição: Universidade Federal Fluminense
Resumo
Objetivo: Alertar sobre a importância do controle glicêmico adequado na regressão do quadro clínico da Síndrome de Mauriac (SM).
DESCRIÇÃO DO CASO: CJOS, 9 anos e 7 meses, sexo feminino. Ao longo de 8 anos, teve múltiplas internações por cetoacidose diabética e hiperglicemia, uma das quais ocorreu em novembro de 2014 no Hospital Universitário Antônio Pedro (HUAP). Apresentava atraso do desenvolvimento pôndero-estatural, estando abaixo do percentil 15; porém, com índice de massa corporal (IMC) próximo do percentil 50. Também detinha glicohemoglobina (HbA1c) de 13,3%, hipertrigliceridemia, hipercolesterolemia, aumento das transaminases e inversão do padrão albuminaglobulina. Após alta com terapia adequada, foi internada novamente em fevereiro de 2015 por falta de adesão ao tratamento e de manutenção do descontrole glicêmico. Foi realizada ultrassonografia abdominal, que mostrou hepatomegalia difusa com contornos regulares. Os exames laboratoriais mostraram alterações similares aos da internação em 2014. A paciente foi tratada com insulinização venosa e recebeu alta com plano terapêutico ambulatorial.
DISCUSSÃO: A Síndrome de Mauriac é uma forma rara de diabetes mellitus do tipo 1 (DM1), uma das doenças mais importantes em pacientes pediátricos. Caracteriza-se pela tríade: hepatomegalia, retardo do crescimento e diabete mal controlado, por um período de longa duração. O quadro clínico é explicado pelo descontrole glicêmico e pelas alterações endócrinometabólicas, causadas pela hiperglicemia e pela insulinoterapia. O diagnóstico é clínico, e a base do tratamento é o rígido controle glicêmico, podendo levar à regressão dos sintomas que caracterizam a síndrome.
Palavras-chave: Diabetes mellitus tipo 1, glicogênio hepático, hepatomegalia, Síndrome de Mauriac.
Abstract
OBJECTIVE: This article aims to alert about the importance of adequate glycemic control in the regression of Mauriac Syndrome.
CASE DESCRIPTION: CJOS, 9 years and 7 months, female. At eight years-old, she was hospitalized many times due to diabetic ketoacidosis and hyperglycemia, one of them in November 2014 at Hospital Universitário Antônio Pedro (HUAP). She had delayed growth and weight gain, below 15th percentile, but with body mass index (BMI) near of 50th percentile. She also presented glycohemoglobin (HbA1c) of 13.3%, hypertriglyceridemia, hypercholesterolemia, increase in transaminases and inversion of albumin and globulin standard. After adequate therapy and being discharged, she was hospitalized again in 2015, for lack of adhesion to treatment and maintenance of uncontrolled glycaemia. Abdominal ultrasound showed diffuse hepatomegaly with regular contours. Laboratory tests showed similar changes in 2014. The patient was treated with intravenous insulinization and was discharged with outpatient treatment plan.
DISCUSSION: Mauriac Syndrome is a rare form of type 1 diabetes mellitus, one of the most important diseases in pediatric patients. It is characterized by the triad hepatomegaly, growth delay and long term poorly controlled diabetes. The clinical case is explained by the loss of glycemic control and the endocrine and metabolic changes, which were caused by hyperglycemia and insulin therapy. The diagnosis is clinical, and the mainstay of treatment is the hard glycemic control, which may lead to regression of the syndrome symptoms.
Keywords: Type 1 Diabetes mellitus, liver glycogen, hepatomegaly, Mauriac Syndrome.
INTRODUÇÃO
Em 1930, Mauriac descreveu uma menina de 10 anos, diabética mal controlada, que apresentava hepatomegalia, distensão abdominal, nanismo, face em forma de lua cheia e deposição de gordura sobre os ombros e o abdome. Posteriormente, ela sofreu episódios de cetose e puberdade retardada. Na época, o tratamento fundamentava-se no uso de insulina de curta ação. Já no final dos anos 1930, Joslin Clinic também relatou uma série de casos de 60 jovens com hepatomegalia, insuficiência de crescimento, maturação sexual retardada e diabetes de difícil controle, com incidência equivalente entre homens e mulheres, sendo a maioria deles durante a adolescência.1
Duas formas diferentes da Síndrome de Mauriac têm sido descritas, com base na presença ou na ausência de obesidade. Recentemente, a Síndrome de Mauriac foi relatada em pacientes que não são obesas e sem histórico de hipoglicemia e cetoacidose alternada, as quais receberam, regularmente, insulina em subdoses. Percebeu-se que períodos de hiperinsulinização parecem estar relacionados ao desenvolvimento da obesidade e à indução de hiperadrenalismo.2
A relação direta entre o desenvolvimento do indivíduo e o mecanismo da síndrome é multifatorial.3 A oferta inadequada de glicose tissular parece estar associada a níveis diminuídos do fator 1 de crescimento semelhante à insulina e de GH, além de hipercortisolismo e de resistência do receptor hormonal de insulina. Os períodos de doses suprafisiológicas da insulina estão diretamente associados à hepatomegalia, devido à deposição de glicogênio no fígado. Simultaneamente, a deposição subcutânea da mesma substância origina faces em lua cheia.4
Observa-se que o quadro clínico caracterizado por deficiência de crescimento, puberdade atrasada e hepatomegalia melhora com controle glicêmico adequado. O objetivo deste artigo é relatar o caso de uma criança de 9 anos e 7 meses, portadora da síndrome, diagnosticada com DM1 desde 1 ano e 3 meses de idade, em acompanhamento pelos setores de Pediatria e Endocrinologia do Hospital Universitário Antônio Pedro da Universidade Federal Fluminense (HUAPUFF).
DESCRIÇÃO DO CASO
CJOS, 9 anos e 7 meses, sexo feminino, natural e procedente da Cidade de São Gonçalo, Estado do Rio de Janeiro. Aos 15 meses, apresentou poliúria, polidipsia, recusa alimentar e emagrecimento, evoluindo com desidratação. Na ocasião, foi confirmado o diagnóstico de diabetes mellitus do tipo 1, por meio de exames laboratoriais que apresentavam HbA1c de 9,1 e HGT em jejum de 340mg/dL, e iniciado insulinoterapia convencional e orientação nutricional.
Ao longo de 8 anos teve múltiplas internações por cetoacidose diabética e hiperglicemia, sendo uma delas em novembro de 2014, quando foi internada no HUAPUFF.
Ao exame clínico, apresentava atraso de desenvolvimento pôndero-estatural, com estatura de 127cm, estando abaixo do percentil 15 (curva estatura vs. idade, do Ministério da Saúde, Organização Mundial da Saúde – OMS). Entretanto, apresentava índice de massa corporal (IMC) de 15,6kg/m², estando próximo do percentil 50 (curva IMC vs. idade do Ministério da Saúde, OMS).
A propedêutica laboratorial evidenciou glicemia de jejum de 186mg/dL (VN: 70110) e glicohemoglobina (HbA1c) de 13,3% (VN: <7,9%). Triglicerídeos de 279md/dL (VN: 30130) e colesterol total de 244mg/dL (VN: 50150). Sorologias para hepatite B e C não reativas; AST de 36U/L (VN: 1537); ALT de 38 U/L (VN: 1459); e GGT de 43 U/L (VN: 555). Proteínas totais de 6,3g/dL (VN: 6,48,2); albumina de 3,0g/dL (VN: 3,45,0); e globulina de 3,3g/dL (VN: 2,43,7), evidenciando uma inversão na relação albuminaglobulina. A dosagem de IGF1 não foi realizada, pois a paciente não realizou o controle glicêmico durante o acompanhamento ambulatorial e durante as internações.
Optouse pela correção do esquema terapêutico de insulina, seguido de acompanhamento ambulatorial com nutricionista e endocrinologista. Todavia, por falta de adesão ao tratamento, a paciente desenvolveu novo quadro de cetoacidose diabética, necessitando de outra internação hospitalar e tratamento com insulinoterapia intravenosa, em fevereiro de 2015. Além disso, presentava hepatomegalia, com abdome distendido e doloroso à palpação. Permaneceu internada em tratamento com insulinoterapia e dieta apropriada e, após manutenção de melhor controle glicêmico, recebeu alta hospitalar.
Entre os exames laboratoriais de admissão solicitados, a gasometria arterial teve pH 7,31 (VN: 7,35-7,45); pCO2 38mmHg (VN: 3545); HCO3 18,9mmol/L (VN: 2226); BE 7,33mmol/L (VN: 2 a +2) e glicose 371mg,dL. Os demais exames laboratoriais de admissão evidenciaram glicemia de jejum de 691mg/dL (VN: 70110) e glicohemoglobina (HbA1c) de 10,3% (VN: <7,9%). Apresentou leucócitos de 17.800, com 5% de bastões; plaquetas de 590.000 (VN: 150400); ureia de 61 mg/dL (VN: 1545); e creatinina de 1,32mg/dL (VN: 0,31). EAS e urinocultura estavam normais. Triglicerídeos de 294md/dL (VN: 30130) e colesterol total de 236mg/dL (VN: 50150). AST de 23U/L (VN: 1537); ALT de 27 U/L (VN: 1459); FA 289U/L (VN: até 455); e GGT de 44 U/L (VN: 555). Proteínas totais de 7,1g/dL (VN: 6,48,2); albumina de 3,8g/dL (VN: 3,45,0); e globulina de 3,3g/dL (VN: 2,43,7). TSH 2,57 UI/mL (VN: 0,44) e T4 livre de 1,1ng/dL (VN: 0,891,76). No decorrer da internação, a glicemia apresentou melhora, assim como a queda de leucocitose, plaquetas, ureia e creatinina.
Foi realizada uma ultrassonografia de abdome total (Figuras 1 e 2), tendo como laudo "hepatomegalia difusa, com contornos regulares, ecotextura finamente heterogênea, sem lesões focais". Sem outras alterações.
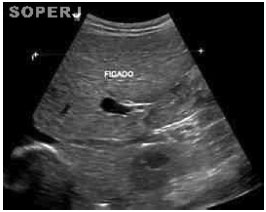
Figura 1. Ultrassonografia de abdome, mostrando fígado com volume aumentado (hepatometria difusa), contornos regulares e ecotextura finamente heterogênea. Hepatometriadireita: 15,0cm; hepatometria esquerda: 10,0cm.
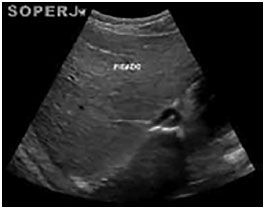
Figura 2. Ultrassonografia de abdome, mostrando fígado com volume aumentado (hepatometria difusa), contornos regulares e ecotextura finamente heterogênea. Hepatometriadireita: 15,0cm; hepatometria esquerda: 10,0cm.
Solicitou-se fundoscopia para Oftalmologia, com o seguinte laudo: "Presença de brilhos maculares sugestivos de drusas; vasos preservados; microaneurisma temporal em olho direito". Foi orientada a realização semestral de fundoscopia.
A presença de DM1 descompensado de longa evolução, déficit de crescimento e puberal, hepatomegalia, aumento das transaminases, hipercolesterolemia e inversão do padrão albuminaglobulina levaram à suspeita de Síndrome de Mauriac.
DISCUSSÃO
O caso descrito preenche os critérios necessários ao diagnóstico de Síndrome de Mauriac, que cursa com a tríade característica: hepatomegalia, retardo de crescimento e diabetes mal controlado de longa duração. Tratase de uma forma rara de diabetes mellitus tipo 1 que acomete, sobretudo, crianças e adolescentes.1
O retardo de crescimento característico da síndrome possui estreita relação com o controle glicêmico.3 Um estudo realizado no Brasil demonstrou essa relação ao acompanhar o crescimento físico de 72 pacientes com DM1, com idade média de 21 anos e tempo de diabetes de 11,9 anos.6 Uma das teorias aponta que o inadequado controle glicêmico resultaria em níveis baixos de IGF1, substância essencial para o crescimento. É importante ressaltar que o déficit de crescimento físico na SM não é acompanhado por retardo no desenvolvimento neurológico ou psíquico, bem como o índice de massa corporal é normal, o que também foi observado em nossa paciente.
O aumento do fígado indica infiltração gordurosa e glicogênica, com predomínio desta. Esse acúmulo em pacientes com DM1 é ocasionado pela hiperglicemia secundária ao descontrole glicêmico. Apesar dos níveis elevados de glicose sérica, sua utilização pelas células está reduzida em consequência do déficit de insulina, característico dos diabéticos tipo 1. Assim, o fígado tenta compensar essa condição aumentando a produção de glicose a partir de precursores não glicídicos, processo conhecido como gliconeogênese.
Dessa forma, maior quantidade de glicose é lançada na corrente sanguínea, aumentando ainda mais a glicemia. A isso, soma-se o fato de que os pacientes com DM1 apresentam aumento da atividade da enzima glicose 6 fosfatase, responsável por maior saída de glicose da célula hepática para o sangue, mesmo em estados de hiperglicemia intensa.7
É importante diferenciar a hepatopatia glicogênica, mais comum em pacientes diabéticos tipo 1, com mau controle glicêmico, da esteatose hepática não alcoólica, em pacientes obesos e com diabetes tipo 2, visto que a primeira doença seria reversível com melhor controle glicêmico, enquanto, na segunda, ocorreria maior propensão à cirrose ainda na adolescência.8
A hepatopatia glicogênica ocorre pela entrada passiva da glicose sérica ao serem administradas doses suprafisiológicas de insulina exógena, como também pela dificuldade dos hepatócitos em eliminar essa glicose.9 As enzimas responsáveis pela fixação da glicose nas células, em especial as hexoquinases e as glucoquinases, estão reduzidas na DM1, o que acarreta maior dificuldade de eliminação da glicose do fígado, levando ao acúmulo de glicogênio glicogenose diabética. Nessa situação, o fígado pode tornarse grande, doloroso à palpação, de consistência firme e borda lisa,7 como visto no presente caso. Na segunda doença, ocorre acúmulo de lipídios no fígado, como resultado da hiperinsulinemia crônica e resistência à insulina hepatocelular.
A biópsia hepática está indicada apenas em casos mais graves em que o diagnóstico não está bem estabelecido.10 O achado de glicogenose não é patognomônico da SM, podendo estar presente em qualquer quadro de diabetes não controlada. Um estudo realizado no Brasil mostrou a presença de hepatomegalia em 9% dos pacientes bem controlados, 60% dos pacientes com DM descompensado e 100% naqueles com cetose. Yokoyama e cols. relataram que a hepatomegalia concomitante à DM1 mal controlada é muito sugestivo de SM, principalmente quando acompanhada de déficit de crescimento.12
É importante ressaltar que devem ser excluídas causas infecciosas de hepatomegalia, como hepatites e tuberculose. A história de passado vacinal completo, a ausência de quadro clínico sugestivo de processo infeccioso e as sorologias negativas para hepatite foram importantes para a exclusão de quadro infeccioso no referido caso.3
A paciente em questão apresenta sinais de retinopatia diabética, a qual pode evoluir com pior progressão caso não se realize controle glicêmico adequado.13 Os portadores de DM1 estão sujeitos a complicações microangiopáticas, cujo rastreio é preconizado 5 anos após o diagnóstico. Apesar de poucos estudos sobre essa síndrome, acreditase que o quadro de SM possa aumentar as chances de evolução para essas complicações, visto que não há rígido controle glicêmico, o que é essencial para o curso favorável da doença.14 As lesões em órgãosalvo, como, por exemplo, rins, coração e olhos, podem ser observadas de forma precoce nesses pacientes.
O diagnóstico da Síndrome de Mauriac é eminentemente clínico.1 A anamnese e o exame físico detalhados são essenciais para a avaliação do paciente, associados aos dados laboratoriais de provas de função hepática alteradas e hipercolesterolemia, como evidenciado no relato. A dosagem de IGF1 pode colaborar com o diagnóstico, devendo ser solicitada em momento de adequado controle glicêmico.15
O tratamento da SM é o mesmo preconizado para as formas convencionais de DM1; no entanto, deve existir um controle insulínico com monitorização rígida dos níveis glicêmicos.13 Um estudo publicado em 1981 apresentou 4 casos de SM e observou que, após o controle glicêmico rígido, ocorreu aceleração do padrão de crescimento dos pacientes, redução da hepatomegalia e desenvolvimento puberal.14
O prognóstico é reservado e o diagnóstico deve ser o mais precoce possível para que se estabeleça o tratamento intensivo em tempo hábil. É de extrema importância que o portador de SM esteja ciente de sua condição clínica, bem como de sua evolução, e que seja estabelecida uma boa relação entre o paciente e a equipe de saúde. A adesão ao tratamento é o alicerce para o controle da doença e a regressão do quadro clínico da Síndrome de Mauriac, visando reduzir a morbimortalidade à doença.
O presente estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal Fluminense, em 2 de outubro de 2009 (CAAE no 0154.0.258.00009).
REFERÊNCIAS BIBLIOGRÁFICAS
1. Mandel F, Berenberg W. The Mauriac syndrome: Am J Dia Child 1974;127:900.
2. Tulzer W, Ploier R. Pathogenic investigations on a case of Mauriac syndrome. Pediatr Pathol 1976;11:35663.
3. Mauras N, Merimee T, Rogol AD. Function of growth hormoneinsulinlike growth factor I axis in the profoundly growthretarded diabetic child: evidence for defective target organ responsiveness in the Mauriac syndrome. Metabolism 1991;40:110611.
4. Gutch M, Philip R, Saran S, Tyagi R, Gupta KK. Reemergence of a rare syndrome: A case of Mauriac syndrome. Indian J Endocrinol Metab 2013;17(Suppl1):S283S285.
5. Madhu SV, Jain R, Kant S, Prakash V. Mauriac syndrome: a rare complication of type 1 diabetes mellitus. Indian J Endocrinol Metab 2013;17(4):764765.
6. Rodrigues TMB, Silva IN. Estatura final de pacientes com diabetes mellitus tipo 1. Arq Bras Endocrinol Metab 2001;45:10814.
7. Vo HDT, Klein GW, Loizides A, Zhou P, Liu Q, Pan DH. Glycogen hepatopathy in children with poorly controlled type 1 diabetes. Intern J Case Reports Images 2011;2:14.
8. Pashkova VS, Filippova LA, Bobrovskikh MP. Secondary glycogenosis (Mauriac syndrome) in a young man with diabetes mellitus. Arkh Patol 1994;56:7980.
9. Mauriac P. Grosventre, hepatomegalie, troubles de la croissance chez les enfantsdiabetques, traits depuisplusieursanbnees par l'insuline. Gaz Hebd Sci Med Bordeux 1930;51:402.
10. Lorenz G. Bioptical liver changes in Mauriac syndrome. Zentralbl Allg Pathol 1981;125:3648.
11. Sherlock S. O fígado nos distúrbios metabólicos. In: Sherlock S, editor. Doenças do fígado e do sistema biliar. 5a ed. Rio de Janeiro: Guanabara Koogan; 1978. p.37584.
12. Yokoyama M, Noto Y, Kida H. Hypotermia with acute renal failure in a patient suffering from diabetic.
13. Daneman D, Drash AL, Lobes LA. Progressive retinopathy with improved control in diabetic dwarfism (Mauriac sydrome). Diabetes Care 1981;4:3605.
14. Shrivastava MS, Palkar AV, Padwal NJ, Moulick N. Reversible steatohepatosis in a young boy with brittle type 1 diabetes mellitus: Mauriac syndrome. BMJ Case Rep 2011.
15. Simsek E. Insulinlike growth factor (IGFI) in Mauriac syndrome or diabetic dwarfism. Turk J Med Sci 2002;32:4214.






