Número atual: 15(1) - Fevereiro 2015
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
ARTIGOS ORIGINAIS
Colonização nasal e infecção por Staphylococcus aureus e Staphylococcus aureus resistente à meticilina em crianças com varicela
Staphylococcus aureus and methicillin-resistant Staphylococcus aureus nasal carriage and infection in children with varicella
Maria Isabel Brandão Pires e Albuquerque1; Fábio Aguiar Alves2; Luis Guillermo Coca Velarde3; Marcos Gabriel Pinheiro4; Edilene Macedo Lima5; Ana Tereza Antunes Monteiro de Souza6; Bianca Dray Marassi7; Claudete Aparecida Araújo Cardoso8
1. Mestre em Ciências da Saúde pela Faculdade de Medicina da Universidade Federal Fluminense Hospital Federal da Lagoa
2. Pós-Doutorado pela Universidade da Califórnia em Berkeley Universidade Federal Fluminense
3. Doutorado em Engenharia de Produção pela Universidade Federal do Rio de Janeiro Universidade Federal Fluminense
4. Mestre em Patologia pela Faculdade de Medicina da Universidade Federal Fluminense Universidade Federal Fluminense
5. Bióloga pelo Centro Universitário Augusto Mota Hospital Municipal Miguel Couto
6. Especialista em Cardiologia Infantil pelo Hospital Universitário Pedro Ernesto. Hospital Federal da Lagoa
7. Especialista em Pediatria pelo Hospital Municipal Miguel Couto Hospital Municipal Miguel Couto
8. Pós-Doutorado pela Universidade da Califórnia em Berkeley Universidade Federal Fluminense
Endereço para correspondência:
Claudete Aparecida Araújo Cardoso
Departamento Materno Infantil - Faculdade de Medicina - Universidade Federal Fluminense
Av. Marques de Paraná, 303 - Centro
Niterói - RJ - Brasil - CEP: 24033-990
Telefone: 2629-9031 / 2629-9190
E-mail: claudetecardoso@id.uff.br
Resumo
OBJETIVO: Estudar prevalência de colonização nasal e infecção por Staphylococcus aureus (S. aureus) e S. aureus resistente à meticilina associado à comunidade (CA-MRSA) em crianças com varicela atendidas em nível hospitalar, avaliando a presença de infecção secundária e o desfecho clínico.
MÉTODOS: Trata-se de um estudo de corte transversal, em que se aplicaram questionários acerca dos fatores de risco para colonização e infecção por S. aureus, bem como se coletou suabe nasal. A resistência à meticilina foi confirmada pela detecção do gene mecA pela técnica de reação em cadeia da polimerase (PCR). Adicionalmente, a gravidade dos casos foi estimada por meio do Pediatric Risk of Mortality score (PRISM), e avaliou-se o desfecho clínico dos pacientes internados. As variáveis categóricas foram comparadas por meio do teste do qui-quadrado ou do exato de Fisher. Considerou-se p-valor < 0,05 estatisticamente significativo.
RESULTADOS: Foram incluídos 55 pacientes. A prevalência da colonização nasal por S. aureus foi de 34,5%; enquanto a de CA-MRSA foi de 7,3%. A análise bivariada demonstrou significância estatística entre a colonização por S. aureus e as seguintes variáveis: sexo masculino, complicações infecciosas, infecção de pele, uso de beta-lactâmicos, internação e familiar da área da saúde (p < 0,05). O PRISM mediano dos pacientes colonizados por MRSA foi de 4,3% e dos não colonizados foi de 0,7%. Avaliou-se o desfecho clínico de 26 pacientes internados, sendo o PRISM mediano dos colonizados por MRSA de 23,6% e dos não colonizados de 0,8%.
CONCLUSÕES: Há evidências de que o aumento nas taxas de colonização por CA-MRSA contribua para o aumento na gravidade dos casos de infecção secundária em pacientes pediátricos com varicela, sugerindo que o esquema antimicrobiano empírico inicial nos casos mais graves inclua agentes com atividade contra CA-MRSA.
Palavras-chave: Staphylococcus aureus. Staphylococcus aureus resistente a meticilina. Cavidade nasal. Crianças. Varicela.
Abstract
OBJECTIVE: To study the prevalence of nasal colonization with CA-MRSA in children with chickenpox treated at hospital level, assessing the presence of secondary infection and clinical outcome.
METHODS: Cross-sectional study. A questionnaire assessing risk factors for colonization and infection with S. aureus was applied and nasal swab was collected. The resistance to methicillin was confirmed by detection of the mecA gene by PCR. The severity of cases was estimated using the Pediatric Risk of Mortality score (PRISM) and the clinical outcome of hospitalized patients was assessed. Categorical variables were compared using the chi-square or the Fisher's exact test, and p-value< 0.05 was considered statistically significant.
RESULTS: 55 patients were included in the study. The prevalence of S. aureus nasal colonization was 34.5% and CA-MRSA was 7.3%. Bivariate analysis showed statistical significance between colonization with S. aureus and male gender, infectious complications, skin infection, use of beta-lactams and health worker in the family (p < 0.05). The median PRISM of the patients colonized with MRSA was 4.3% and in the non-colonized was 0.7%. Clinical outcome of 26 inpatients was evaluated. The median PRISM of patients colonized with MRSA was 23.6% and non-colonized was 0.8%.
CONCLUSIONS: There is evidence that the increase in rates of colonization with CA-MRSA contributes to an increase in the severity of cases of secondary infection in pediatric patients with chickenpox suggesting that the initial empirical antimicrobial therapy in severe cases should include an anti-MRSA agent.
Keywords: Staphylococcus aureus. Methicillin-resistent Staphylococcus aureus. Nasal cavity. Children. Varicella.
INTRODUÇÃO
A varicela é uma doença infecciosa comum na infância, geralmente benigna e autolimitada; porém, altamente infecciosa, com uma taxa de contágio que varia de 61 a 100%.1 A maioria dos casos de varicela ocorre em crianças com menos de 10 anos de idade, no final do inverno e no início da primavera.2 Ocorre em todo o mundo e é endêmica na maior parte das populações, principalmente em países como o Brasil, que, até o final de 2013, ainda não tinha a vacina disponível para todas as crianças no sistema público de saúde. Essa situação acarreta um fardo social importante para os pacientes e seus cuidadores, uma vez que gera absenteísmo à escola e ao trabalho.3
As complicações mais frequentemente observadas na varicela são as infecções bacterianas secundárias, que podem acometer a pele e o tecido subcutâneo e ocasionar casos graves de pneumonia e sepse, sendo responsáveis por 30% a 70% das internações dos pacientes com a doença. Nos últimos anos, tem-se observado um considerável aumento na incidência de infecções bacterianas graves em pacientes pediátricos com varicela.3-6 O S. aureus é uma das bactérias mais comumente isoladas nesses pacientes.3-5
Cerca de 20% a 40% da população humana é portadora nasal de S. aureus.7 A infecção geralmente ocorre quando há perda da barreira de pele e/ou mucosa, permitindo acesso aos tecidos adjacentes e à corrente sanguínea. Vários estudos demonstram uma relação direta entre portadores nasais de S. aureus e o subsequente desenvolvimento de infecções estafilocócicas, sendo a cepa invasiva indistinguível da cepa colonizadora.8-11
Na década de 1960, verificou-se o surgimento de cepas de S. aureus resistentes à meticilina (MRSA) associadas à assistência à saúde, o que tornou o S. aureus um desafio ainda maior.12,13 No início da década de 1990, foram registrados surtos de cepas de MRSA em comunidades que não tinham qualquer relação com os serviços de saúde, sendo denominadas MRSA associado à comunidade (CA-MRSA).14
O tratamento da infecção bacteriana secundária grave de origem comunitária em pacientes com varicela é usualmente realizado com o uso de antimicrobianos beta-lactâmicos, como, por exemplo, a oxacilina. Em populações em que a prevalência de colonização por CA-MRSA ultrapassa 10% a 15%, é recomendada a cobertura empírica inicial para CA-MRSA em casos de infecção de pele e tecido subcutâneo.15-17 O CA-MRSA apresenta resistência a todos os antimicrobianos beta-lactâmicos e sensibilidade a sulfametoxazol-trimetoprim, clindamicina e/ou ciprofloxacina.18,19
A prevalência de colonização nasal por CA-MRSA entre as crianças no Município do Rio de Janeiro, assim como as características das cepas circulantes, ainda não foi descrita. Considerando que a prevalência de colonização nasal por CA-MRSA e as características das cepas apresentam grande variação em todo o mundo, mesmo em localizações geográficas diferentes dentro de um mesmo país,20,21 e que os pacientes pediátricos com varicela estão mais expostos à infecção secundária por S. aureus devido à perda de barreira causada pelas lesões de pele, é de extrema importância conhecer, em nível local, a prevalência de colonização por CA-MRSA, com o objetivo de adequar a antibioticoterapia empírica inicial nesse grupo específico de pacientes.
Os objetivos do presente estudo foram: (i) estudar a prevalência de colonização nasal por CA-MRSA em crianças com varicela atendidas em nível hospitalar; (ii) avaliar a presença de infecção secundária nos pacientes colonizados por S. aureus; e (iii) avaliar o desfecho clínico dos pacientes internados devido à infecção secundária.
MÉTODOS
Trata-se de estudo de corte transversal, conduzido em 4 hospitais públicos (2 terciários e 2 secundários de grande porte) no Município do Rio de Janeiro, entre agosto e dezembro de 2012. Selecionaram-se os pacientes pediátricos admitidos nos Ambulatórios de Especialidades Pediátricas, Emergência, Enfermaria Pediátrica ou Unidade de Terapia Intensiva Pediátrica dos hospitais participantes durante o período do estudo. Todas as crianças atendidas com varicela e seus responsáveis legais foram abordados e convidados a participar do projeto no momento da chegada ao hospital ou, no caso de pacientes internados, nas primeiras 48 horas de internação.
O questionário avaliou a presença de potenciais fatores de risco para a colonização por S. aureus e a infecção bacteriana secundária em pacientes com diagnóstico prévio de infecção por varicela, como, por exemplo, sexo, idade, hospitalização recente (no último ano), uso de antibióticos (30 dias anteriores), frequência em creche, compartilhamento de objetos de higiene pessoal, familiar da área da saúde, número de contatos domiciliares e renda familiar.
A coleta de secreção nasal foi realizada por meio de rotação de suabe seco e estéril (Citowest Labware Manunfacturing, Haimen Town, China), no vestíbulo anterior de ambas as narinas de todos os pacientes participantes do estudo. As amostras coletadas foram semeadas em ágar manitol salgado (Plastlabor, Rio de Janeiro, Brasil) e incubadas por 24 horas a 37ºC. Todas as colônias fermentadoras de manitol foram testadas para resistência a antimicrobianos por meio da utilização de discos de cefoxitina e oxacilina, bem como no Vitek (Biomerieux, França) para benzilpenicilina, cotrimoxazol, clindamicina, oxacilina, vancomicina e ciprofloxacina (Interlab, São Paulo, Brasil). Foi realizada reação em cadeia da polimerase (PCR) para a detecção do gene mecA em todos as amostras consideradas MRSA22 pela fenotipagem, e os tipos de SCCmec foram determinados por PCR multiplex.23
As variáveis numéricas foram apresentadas como medianas; e as categóricas, como n e porcentagem (%). Além disso, as variáveis categóricas foram comparadas em relação à colonização nasal por S. aureus por meio do teste do qui-quadrado ou pelo exato de Fisher, e p-valor < 0,05 foi considerado estatisticamente significativo. Os dados obtidos a partir de questionários foram inseridos em um banco de dados, e as análises estatísticas foram realizadas com o programa SPSS 17.0.0 (SPSS, Chicago, IL).
Para obter o número de internações de pacientes pediátricos em hospitais públicos no município do Rio de Janeiro, no período do estudo, utilizou-se o programa TabNet, disponibilizado no site DATASUS. Já para estratificar os pacientes internados pela gravidade dos casos, foi utilizado o Pediatric Risk of Mortality Score (PRISM). O PRISM é um escore preditivo de mortalidade que consiste na avaliação de 14 variáveis fisiológicas, com 23 zonas de variação. Para tal cálculo foi considerado o pior valor de cada variável durante as primeiras 24 horas após a admissão.24
Também se realizou uma avaliação retrospectiva por meio da revisão de prontuários dos pacientes pediátricos com varicela, que foram internados de 2010 a 2013 nos quatro hospitais incluídos no presente estudo.
o presente estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Antônio Pedro da Universidade Federal Fluminense, sob o protocolo nº 01739812.3.0000.5243, bem como por cada um dos quatro centros participantes deste estudo. Os responsáveis pelas crianças assinaram o termo de consentimento antes de qualquer procedimento do estudo.
RESULTADOS
No período de agosto a dezembro de 2012, 55 pacientes admitidos nos quatro hospitais participantes preencheram os critérios predefinidos e foram incluídos no estudo. Em relação ao tipo de atendimento, 5/55 (9,1%) dos pacientes realizaram apenas consulta ambulatorial, e 32/55 (58,2%) foram atendidos na pequena emergência, sendo liberados para casa após a realização de consulta pelo médico responsável. Os demais pacientes incluídos no estudo, 18/55 (32,7%), foram internados para uso de medicação intravenosa ou suporte de terapia intensiva em UTI pediátrica (Tabela 1).

A mediana de idade dos participantes foi de 3 anos de vida (IIQ = intervalo interquartil: 1, 6-5) e 34 (61,8%) eram do sexo masculino. Houve predomínio das raças parda e branca, com 22/55 (40%) e 21/55 (38,2%) pacientes, respectivamente. A maioria deles provinha da Zona Oeste, dos quais 32 (58,2%) residiam em Jacarepaguá.
Do total de 55 pacientes, 29 (52,7%) frequentavam creche; 6 (10,9%) foram internados por mais de 24 horas no ano anterior; 3 (5,5%) tiveram contato íntimo diário com algum familiar que trabalha na área de saúde; e 14 (25,5%) utilizaram antibióticos betalactâmicos nos últimos 30 dias que precederam a entrevista.
Em relação às mães dos pacientes, 28 (50,9%) concluíram acima de 8 anos de educação formal, e 8 (14,5%) eram fumantes. Em 39 (70,9%) das moradias dos pacientes, residiam menos de 4 pessoas, e 43 pacientes (78,2%) compartilhavam com familiares, pelo menos, um item de uso pessoal, como, por exemplo, sabonete, toalha, lençol, roupas ou sapatos.
Verificou-se a colonização nasal por S. aureus em 19 dos 55 pacientes, sendo a prevalência de 34,5% no total da amostra. Em 4 (21,1%) desses 19 pacientes, os S. aureus isolados foram caracterizados fenotipicamente como MRSA e confirmados pela presença do gene mecA. Portanto, a prevalência de colonização nasal por MRSA foi de 7,3% (4/55). Todos os MRSA apresentavam SCCmec do tipo IV, sendo considerados CA-MRSA, e, no perfil do antibiograma, apresentavam resistência à oxacilina e cefoxitina. Todavia, eram sensíveis à clindamicina e ao cotrimoxazol.
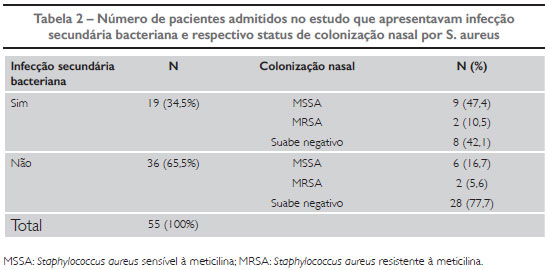
Dos 55 pacientes, 19 (34,5%) apresentaram sinais clínicos de infecção secundária no momento em que foram incluídos no estudo. Verificamos que 11/19 (57,9%) estavam colonizados por S. aureus, sendo 9/19 (47,4%) por S. aureus sensível à meticilina (MSSA) e 2/19 (10,5%) por MRSA (Tabela 2). Os 2 pacientes admitidos com choque séptico na UTI pediátrica apresentaram colonização nasal por S. aureus, sendo 1 por MRSA.
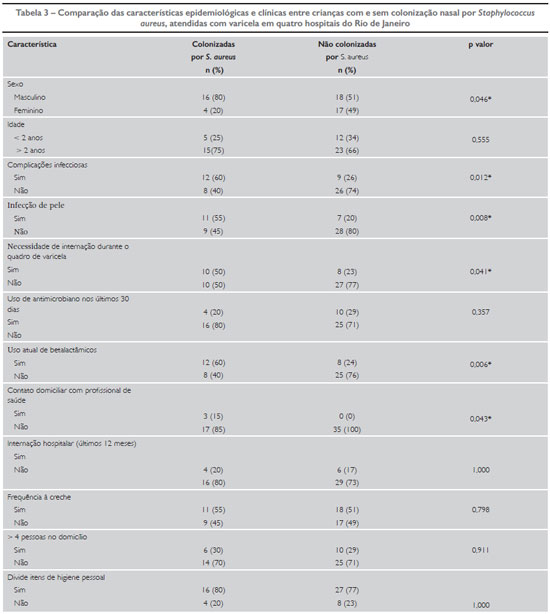
Na análise bivariada, observou-se a significância estatística na associação entre colonização por S. aureus e as seguintes variáveis: sexo masculino (p = 0,046); complicações infecciosas bacterianas nos pacientes com varicela (p = 0,012); paciente com infecção de pele (p = 0,008); uso de betalactâmicos durante o quadro de varicela (p = 0,006); necessidade de internação durante o quadro de varicela (p = 0,041); e familiar que trabalha na área da saúde (p = 0,043) (Tabela 3).
Durante o período do estudo, registrou-se um total de 59 internações em leitos pediátricos de hospitais públicos no Município do Rio de Janeiro, segundo o Departamento de Informática do Sistema Único de Saúde (DATASUS), das quais 18 (30,5%) foram de pacientes incluídos em nosso estudo (Tabela 1).
O PRISM mediano desses 18 pacientes internados que foram admitidos no presente estudo foi de 0,75% (variação - 0,7-17,7). No que se refere à colonização nasal por S. aureus, o PRISM mediano dos pacientes colonizados por MRSA foi de 4,3% (variação - 0,8-7,7), enquanto o dos pacientes não colonizados por MRSA foi de 0,7% (variação - 0,7-17,7).
Complicações relacionadas diretamente à infecção pelo vírus da varicela-zoster ocorreram em 3 pacientes, ao passo que as relacionadas à infecção secundária bacteriana ocorreram em 17/18 dos pacientes internados (94,4%), sendo essa última a principal causa de internação. Apenas 1 dos pacientes não apresentou complicação infecciosa, sendo internado para administração de aciclovir intravenoso por se tratar de um lactente com desnutrição proteico-calórica grau III.
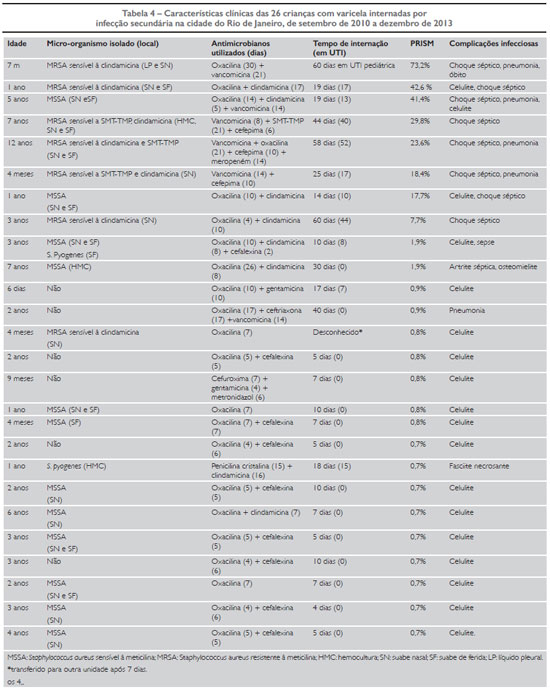
Para a avaliação de desfecho clínico de pacientes internados com varicela e infecção secundária nas unidades participantes do estudo, realizou-se uma análise de 26 pacientes internados no período de 2010 a 2013. Desses pacientes, 17 também fizeram parte do estudo de corte transversal, uma vez que foram atendidos no período entre agosto e dezembro de 2012. Essa amostra compôs-se, inicialmente, por 31 pacientes, dos quais 5 foram excluídos devido à ausência de registro de dados no prontuário.
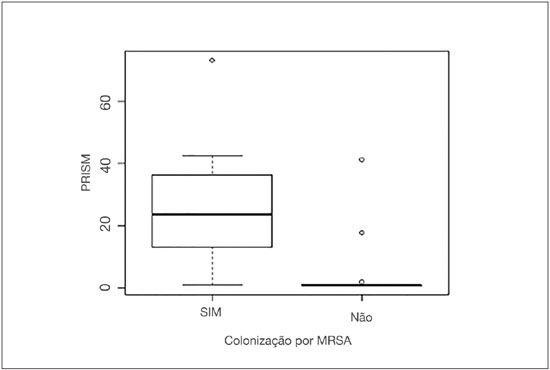
A mediana de idade desses 26 pacientes internados desde 2010 foi de 3 anos de vida (variação - 6 dias-12 anos). A Tabela 4 demonstra as características do quadro clínico das 26 crianças incluídas na avaliação do desfecho clínico, em relação a tempo de internação, antimicrobianos utilizados, gravidade do quadro e desfecho clínico. O PRISM médio dos pacientes colonizados por MRSA foi de 27,3% (mediana = 23,6%), enquanto o dos pacientes não colonizados por MRSA foi de 2,5% (mediana = 0,8%). O Gráfico 1 ilustra a correlação entre o status de colonização nasal por MRSA e o escore PRISM nos 26 pacientes pediátricos com varicela internados com infecção bacteriana secundária no período de 2010 a 2013 nas unidades participantes do estudo.
DISCUSSÃO
Neste estudo, o percentual de colonização nasal por S. aureus foi de 34,5% (19/55), encontrando-se nos níveis descritos na literatura, que variam de 20% a 40%.7 A prevalência de colonização nasal por MRSA foi de 7,3% (4/55), cerca de 6 vezes maior do que a taxa encontrada há 5 anos no único estudo, de nosso conhecimento, realizado no Brasil sobre a prevalência de colonização nasal por CA-MRSA em crianças, especificamente crianças hígidas que frequentavam creches em Goiânia.25 Do total de 1.192 crianças avaliadas, 31,1% apresentavam colonização nasal por S. aureus e 1,2% por MRSA. As cidades do Rio de Janeiro e de Goiânia estão a uma distância aproximada de 950 km, sendo possível que ambas apresentem perfis distintos de colonização.
Além disso, observou-se um aumento nos índices de colonização e de infecção por MRSA na última década em todo o mundo.26,27 Entre 2005 e 2010, uma análise de base populacional analisou a incidência de infecções invasivas por MRSA em pacientes pediátricos em 9 regiões metropolitanas dos Estados Unidos, verificando um acréscimo anual em torno de 10,2% na incidência de infecções invasivas por CA-MRSA em crianças, enquanto a por MRSA associado à assistência hospitalar não variou.28
Outros estudos realizados fora do Brasil evidenciam a grande variação na prevalência de colonização por S. aureus em localizações geográficas diferentes dentro de um mesmo país, confirmando a necessidade de estudos realizados em âmbito local.20,21 Diferentes regiões e populações também vêm apresentando diversos perfis de resistência a antimicrobianos,16 o que é evidenciado com a avaliação molecular. Vários clones circulam nas regiões e diferem em termos de virulência, perfil de resistência antimicrobiana e distribuição geográfica.18,29 Portanto, é de fundamental importância a vigilância epidemiológica local para dar suporte à escolha do tratamento empírico de antibióticos com base no perfil fenotípico e genotípico dos patógenos circulantes nessa população.
Considerando que o S. aureus é um dos principais causadores de infecção secundária em pacientes com varicela, há possibilidade de que a emergência do CA-MRSA possa contribuir para o aumento da morbimortalidade dos pacientes com varicela e infecção secundária ao longo da última década.4-6 Assim como já descrito na literatura, a presença de infecção secundária bacteriana foi a maior causa de internação das crianças com varicela admitidas em nosso estudo, com 94% dos casos.1,3-5
Quando analisamos apenas os pacientes internados devido à infecção bacteriana secundária, encontramos prevalência de colonização nasal por S. aureus de 76,5% (13/17), dos quais 11,8% (2/17) são colonizados por MRSA. A análise bivariada demonstrou associação estatística significativa entre colonização por S. aureus e complicações bacterianas, infecção de pele, necessidade de uso atual de antibióticos, uso atual de antibióticos betalactâmicos e contato com familiar que trabalha na área de saúde. Esses dados estão de acordo com vários estudos que demonstram uma relação direta entre os portadores nasais de S. aureus e o subsequente desenvolvimento de infecções estafilocócicas, em que a cepa invasiva é indistinguível da cepa colonizadora.6,7
Sabe-se que os pacientes pediátricos com varicela têm risco de infecção ainda maior devido ao fato de as lesões de pele típicas da varicela ocasionar quebra de barreira da pele, facilitando a infecção invasiva pelo S. aureus. O PRISM mediano dos pacientes colonizados por MRSA foi de 4,3% (0,8 - 7,7), enquanto o PRISM mediano dos pacientes não colonizados por MRSA foi de 0,7% (0,7-17,7), classificando o risco de mortalidade durante a internação cerca de seis vezes maior nos pacientes colonizados por MRSA.
Quando analisamos o grupo dos 26 pacientes internados com varicela e infecção bacteriana secundária entre 2010 e 2013, verificamos forte associação entre colonização por MRSA e escores PRISM mais elevados e, consequentemente, apresentação de casos mais graves.
Como esperado, as 4 amostras de MRSA do presente estudo apresentavam o gene mecA, sendo caracterizadas como SCCmec tipo IV, que é típico das cepas associadas à comunidade,15 tendo resistência a antibióticos betalactâmicos, mas sensibilidade a cotrimoxazol e/ou clindamicina nos antibiogramas, sendo consideradas CA-MRSA.
Nossos resultados estão de acordo com o único estudo publicado sobre o tema, de nosso conhecimento, realizado na França, no qual 58 amostras de S. aureus foram isoladas de pacientes internados com varicela e infecção estafilocócica comprovada por hemocultura positiva. Foi verificado que 33% das amostras apresentavam o gene mecA e que 100% dessas amostras apresentavam resistência a antibióticos betalactâmicos e sensibilidade à clindamicina, sugerindo serem CA-MRSA.30
CONCLUSÕES
Apesar da limitação do tamanho de nossa amostra, que não nos permite inferir os resultados para toda a população pediátrica com varicela do município do Rio de Janeiro, nossos dados fortalecem a hipótese de que o aumento nas taxas de colonização por CA-MRSA possa contribuir para o aumento na gravidade dos casos de infecção secundária em pacientes pediátricos com varicela e reforçam a recomendação veiculada pela Secretaria Municipal de Saúde do Município do Rio de Janeiro:6 utilizar oxacilina associada à vancomicina como esquema inicial para pacientes com varicela e infecções bacterianas graves associadas com qualquer sinal de sepse ou pneumonia. Mais estudos com um número maior de pacientes e conduzidos de forma prospectiva são necessários, a fim de se avaliar a associação causal entre a presença de CA-MRSA e o pior desfecho clínico dos pacientes.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Ulrich H, Seward JS. Varicella. Lancet. 2006;368:1365-76.
2. Carvalho ES, Martins RM. Varicela: aspectos clínicos e prevenção. Jornal de Pediatria. 1999;75(S1):126-34.
3. Anjos K, Monteiro M, Ferreira E, Arruda M, Ramos KS, Magalhães AP. Caracterização epidemiológica dos casos de varicela em pacientes internados em um hospital universitário da cidade do Recife. Rev Bras Epidemiol. 2009;12(4):523-32.
4. Dubos F, Grandbastien B, Hue V, Martinot A. Epidemiology of hospital admissions for paediatric varicella infections: a one-year prospective survey in the pre-vaccine era. Epidemiol Infect. 2007;135:131-8.
5. Grimprel E, Levy C, de La Rocque F, Cohen R, Soubeyrand B, Caulin E et al. Pediatricians Working Group. Paediatric varicella hospitalisations in France: a nationwide survey. Clin Microbiol Infect. 2007 May;13(5):546-9.
6. Brasil. Ministério da Saúde. Secretaria Municipal de Saúde. Superintendência de Hospitais Pediátricos e Maternidades. Assessoria de Controle de Infecção Hospitalar em Neonatologia e Pediatria. Alerta sobre o risco de infecção por MRSA comunitário em pacientes com varicela. Rio de janeiro; 2014. 2p. Acessado em 20/02/14 no endereço eletrônico: http://www.aeciherj.org.br/publicacoes/informativos-CCIH/Alerta-sobre-risco-irfeccao-MRSA.pdf
7. van Belkum A, Melles DC, Nouwen J, van Leeuwen WB, van Wamel W, Vos MC et al. Co-evolutionary aspects of human colonisation and infection by Staphylococcus aureus. Infect Genet Evol. 2009;9:32-47.
8. von Eiff C, Becker K, Machka K, Stammer H, Peters G. Nasal carriage as a source of Staphylococcus aureus bacteremia. Study Group. N Engl J Med. 2001;344:11-16.
9. Matheson EM, Mainous III AG, Everett CJ, King DE. Tea and Coffe Consumption and MRSA Nasal Carriage. Ann Fam Med. 2011;9:299-304.
10. Safdar N, Bradley EA. The risk of infection after nasal colonization with Staphylococcus aureus. Am J Med. 2006;121:310-5.
11. Nowen JL, Fieren MW, Snijders S, Verburgh HA, van Belkun A. Persistant (not intermitant) nasal carriage of Staphylococcus aureus is determinant of CPD-related infections. Kidney Int 2005;67:1084-92.
12. Jevons MP. "Celbenin".- resistant Staphylococci. BMJ. 1961;1:124-125.12- Kaplan SL. Treatment of Community-Associated Methicillin-Resistant Staphylococcus aureus Infections. Pediatr Infect Dis J. 2005;24:457-8.
13. Parker MT, Hewitt JH. Methicillin resistance in Staphylococcus aureus. Lancet. 1970;295:800-4.
14. Udo EE, Pearman JW, Grubb WB. Genetic analysis of community isolates of methicillin-resistant Staphylococcus aureus in Western Australia. J Hosp Infect. 1993;25:97-108.
15. Kaplan SL, Community Aquired Methicilin-resistant Staphylococcus aureus infection in children. Semin Pediatr Infect Dis. 2006;17:113-19.
16. Moran GJ, Krishnadasan A, Gorwitz RJ, Fosheim GE, McDougal LK, Carey RB, Talan DA. Methicillin-resistant Staphylococcus aureus infections among patients in the emergency department. N Engl J Med. 2006 Aug 17;355:666-74.
17. Daum RS. Clinical Practice: Skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus. N Engl J Med. 2007;357(4):380-90.
18. Rodríguez-Noriega E, Seas C, Guzmán-Blanco M et al. Evolution of methicillin-resistant Staphylococcus aureus clones in Latin America. Int J Infect Dis. 2010;14:560-6.
19. Huang YH, Tseng SP, Hu JM, Tsai JC, Hsueh PR, Teng LJ. Clonal spread of SCC mec type IV methicillin-resistant Staphylococcus aureus between community and hospital. Clin Microbiol Infect. 2007;13:717-24.
20. Velásquez-Guadarrama N, Martinez-Aguilar G, Galindo JA, Zuniga G, Arbo-Sosa A. Methicillin-resistant colonization in Mexican children attending day care centers. Clin Investig Med 2009;32:57-63.
21. Chen CJ, Hsu KH, Lin TY, Hwang KP, Chen, PY, Huang YC. Factors associated with nasal colonization of methicillin-resistant Staphylococcus aureus among healthy children in Taiwan. J Clin Microbiol 2011;49(1):131-7.
22. Clinical and Laboratory Standards Institute. Methods for Dilution Antimicrobial Susceptibility Tests for bacteria That Grow Aerobically. CLSI document M07-A9. Wayne, PA: Clinical and Laboratory Standards Institute, 2012.
23. Oliveira DC, de Lencastre H. Multiplex PCR strategy for rapid identification of structural types and variants of the mec element in methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother, 2002;46:2155-61.
24. Pollack MM, Ruttimann UE, Getson PR. Pediatric risk of Mortality (PRISM) score. Crit Care Med. 1988;16(11):1110-6.
25. Lamaro-Cardoso J, Lencastre H, Kipnis A, Pimenta FC, Oliveira L, Oliveira R et al. Molecular Epidemiology and Risk Factors for Nasal Carriage of Staphylococcus aureus and Methicillin-Resistant S.aureus in Infants Attending Day Care Centers in Brasil. Journal of Clinical Microbiology. 2009 dec: 3991-7.
26. Gorwitz RJ, Kruszon-Moran D, McAllister SK, McQuillan G, McDougal LK, Fosheim GE et al. Changes in the prevalence of nasal colonization with S taphylococcus aureus in the United States, 2001-2004. J Infect Dis. 2008;197:1226-34.
27. Lo WT, Wang CC, Lin WJ, Wang SR, Teng CS, Huang CF et al. Changes in the nasal colonization with methicillin-resistant Staphylococcus aureus in children: 2004-2009. PloS One. 2010;5(12):157-91.
28. Iwamoto M, Mu Y, Lynfield R , Bulens SN, Nadle J, Aragon D et al. Trends in Invasive Methicillin-resistant Staphylococcus aureus infections. Pediatrics. 2013;132(4):817-24.
29. Guzmán-Blanco M, Mejía C, Isturiz R, Alvarez C, Bavestrello L, Gotuzzo E et al. Epidemiology of methicillin-resistant Staphylococcus aureus (MRSA) in latin America. Int J Antimicrob Agents. 2009;34(4):304-8.
30. Raulin O, Durand G, Gillet Y, Bes M, Lina G, Vandenesch F, et al. Toxin Profiling of Staphylococcus aureus Strains Involved in Varicella Superinfection. J. Clin. Microbiol. 2010;48:1696-700.