Número atual: 24(4) - Dezembro 2024
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisao
Hipertensão pulmonar persistente do recém-nascido: revisão de conceitos
Persistent pulmonary hypertension of the newborn: concepts review
Camila Sartorio Barbosa; Luana Carla Lourenço
DOI:10.31365/issn.2595-1769.v24i4p138-148
Sociedade de Pediatria do Estado do Rio de Janeiro, Departamento Científico de Cardiologia Pediátrica, Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Instituição: Sociedade de Pediatria do Estado do Rio de Janeiro, Departamento Científico de Cardiologia Pediátrica, Rio de Janeiro, RJ, Brasil
Recebido em: 25/08/2024
Aprovado em: 18/11/2024
Resumo
A hipertensão pulmonar persistente do recém-nascido (HPPN) é uma síndrome clínica, causada pela persistência da elevada resistência vascular pulmonar após o nascimento. A falha na transição da circulação fetal para neonatal mantém resistências vasculares pulmonares altas, causando hipoxemia e cianose nos recém-nascidos. Em 2018, foi proposta uma nova classificação para a hipertensão pulmonar e, devido a suas particularidades anatômicas e fisiológicas, a HPPN foi movida para uma subcategoria separada (grupo 1; subgrupo 1.6). No entanto, na prática clínica, a classificação mais utilizada é a de hipertensão pulmonar primária ou idiopática e secundária, quando associada a doenças parenquimatosas pulmonares. O diagnóstico inclui história completa dos fatores de risco, exame físico, medição da saturação de oxigênio pré- e pós-ductal, gasometria arterial, raio X de tórax e ecocardiograma. O entendimento do caráter multifatorial da doença tem levado a pesquisas do papel de mediadores inflamatórios e mecanismos genéticos na fisiopatologia da doença. Além do tratamento tradicional, incluindo ventilação mecânica "gentil", manutenção da temperatura corporal, controle de eletrólitos, hidratação, analgesia e sedação, novas estratégias baseadas nas diferentes vias inflamatórias têm sido cada vez mais utilizadas na prática clínica.
Palavras-chave: Hipertensão pulmonar persistente do recém-nascido. Óxido nítrico. Ecocardiografia. Hipoxemia.
Abstract
Persistent pulmonary hypertension of the newborn is a clinical syndrome caused by the persistence of high pulmonary vascular resistance after birth. Failure to transition from fetal to neonatal circulation maintains high pulmonary vascular resistance, causing hypoxemia and cyanosis in newborns. In 2018, a new classification for pulmonary hypertension was proposed, and due to its anatomical and physiological particularities, PPHN was moved to a separate subcategory (group 1; subgroup 1.6). However, in clinical practice, the most used classification is primary and secondary pulmonary hypertension, when associated with parenchymal lung diseases. Diagnosis includes a complete history of risk factors, physical examination, measurement of pre- and pos-ductal oxygen saturation, arterial blood gas analysis, chest X-ray and echocardiogram. Understanding the multifactorial nature of the disease has led to research into the role of inflammatory mediators and genetic mechanisms in the pathophysiology of the disease. In addition to the traditional treatment, including gentle mechanical ventilation, maintenance of body temperature, control of the electrolytes, hydration, analgesia, and sedation, new strategies based on different inflammatory pathways have been increasingly used in clinical practice.
Keywords: Persistent pulmonary hypertension of the newborn. Nitric oxide. Echocardiography. Hypoxemia.
1. INTRODUÇÃO
A hipertensão pulmonar persistente do recém-nascido (HPPN) é uma síndrome clínica caracterizada por insuficiência respiratória hipoxêmica, causada por uma interrupção da transição cardiopulmonar normal ao nascimento. A elevação sustentada da resistência vascular pulmonar (RVP) é a marca registrada da PPHN. É relatada em 0,2% dos nascidos vivos a termo e 2% dos prematuros. Os desfechos da HPPN melhoraram significativamente nas últimas duas décadas, com melhor compreensão da fisiopatologia, diagnóstico e novas estratégias de tratamento.1 Nesta revisão narrativa, iremos discutir sua etiologia, classificação, fisiopatologia, diagnóstico e tratamento.
2. MÉTODO
A busca foi realizada no PubMed, por artigos em inglês de 2019 a 2024, usando termos de pesquisa para hipertensão pulmonar neonatal, como "neonatal pulmonar hipertension", "pulmonar hipertension of the newborn" e "pediatric pulmonar hipertension". Os artigos foram selecionados para inclusão com base em relevância para a prática clínica. Revisões sistemáticas, ensaios clínicos randomizados, grandes estudos observacionais longitudinais e artigos mais recentes foram inicializados. Bibliografias de artigos recuperados foram pesquisadas por outros artigos relevantes. Dos artigos identificados, 17 foram incluídos.
3. CLASSIFICAÇÃO
Durante o sexto Simpósio Mundial de Hipertensão Arterial Pulmonar (HAP), realizado em 2018 em Nice, França, a classificação da HAP foi atualizada, conforme a Tabela 1.
Devido a suas particularidades anatômicas e fisiológicas, a HPPN foi movida para uma subcategoria separada. Embora essa classificação de hipertensão pulmonar pediátrica seja bastante útil, uma classificação mais comumente usada de HPPN é baseada na etiologia - HPPN primária (idiopática) e secundária.
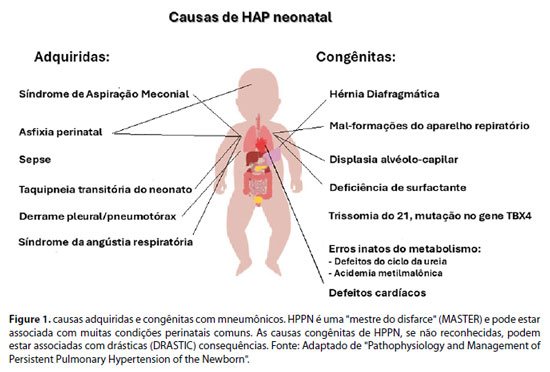
A HPPN primária ou idiopática refere-se à ausência de doença pulmonar parenquimatosa para explicar a pressão arterial pulmonar elevada e implica remodelamento vascular pulmonar intrauterino. Em comparação com a hipertensão pulmonar pediátrica, apenas cerca de 10 a 20% dos casos de HPPN são idiopáticos e a grande maioria dos casos de HPPN decorre da vasculatura pulmonar anormalmente contraída, devido a outros processos de doença respiratória aguda, como síndrome de aspiração meconial (SAM), síndrome de desconforto respiratório (SDR), pneumonia ou hérnia diafragmática congênita (HDC) - isso é chamado de HPPN secundária.2 Dados recentes da Califórnia sugerem que infecção (30%), SAM (24%), idiopática (20%), SDR (7%) e HDC (6%) são as cinco principais causas de HPPN.3 Nesses casos, pode ser difícil separar o remodelamento intrauterino crônico da vasoconstrição pulmonar aguda devido à doença pulmonar parenquimatosa. Uma lista prática de causas secundárias congênitas e adquiridas de HPPN com mnemônicos é mostrada na Figura 1.
4. FISIOPATOLOGIA
4.1. Transição da circulação fetal para neonatal
Na vida fetal, há redução do fluxo sanguíneo pulmonar, sendo a placenta o órgão responsável pela troca gasosa.4 O sangue venoso umbilical proveniente da placenta tem a maior saturação de oxigênio, com uma PaO2 entre 27-35 mmHg.5 O sangue oxigenado que chega ao coração através do ducto venoso (o sangue do ducto venoso praticamente não se mistura com o sangue da VCI) (DV) é direcionado para o AE através do forame oval (FO) para perfundir as circulações coronariana e cerebral. Esse direcionamento acontece pela inclinação e velocidade do sangue do DV com o auxílio da válvula de Eustáquio. Já o sangue desoxigenado, que retorna ao coração através das veias cavas superior (VCS) e inferior (VCI), passa da artéria pulmonar e se junta ao fluxo da aorta, via canal arterial, seguindo para a placenta para ser novamente oxigenado. Os shunts se dão, nas duas situações, da direita para esquerda, devido à alta resistência vascular pulmonar (RVP) e à baixa resistência vascular sistêmica.
No momento do nascimento, uma série de eventos promove a transição da circulação fetal para a neonatal. Quando ocorrem as primeiras incursões respiratórias do recém-nascido (RN), os pulmões inflam, e esta expansão aérea leva à vasodilatação pulmonar, com consequente redução da RVP, permitindo aumento repentino do fluxo sanguíneo pulmonar. O aumento da pressão no átrio esquerdo (AE), secundário ao aumento do retorno venoso pulmonar, promove a inversão do shunt pelo forame oval (FO), passando a ser AE-AD e forçando a membrana da fossa oval contra o septo interatrial, levando ao seu fechamento. O clampeamento do cordão umbilical acarreta o aumento da resistência vascular sistêmica, devido à remoção da circulação placentária de baixa resistência e ao fechamento mecânico do ducto venoso. O aumento da RVS e a redução da RVP levam à reversão do shunt pelo canal arterial, que agora se torna esquerda-direita (Ao-Ap). O aumento gradual da PaO2 junto à queda dos níveis de prostaglandina, que eram produzidos na placenta, ocasiona o fechamento do canal arterial. Qualquer interrupção nesta série de eventos pode manter a RVP elevada, ocasionando a HPPN.6
4.2. Aspectos da fisiopatologia
Alterações na transição da circulação fetal para neonatal podem acarretar persistência da elevada resistência vascular pulmonar e redução do fluxo sanguíneo para os pulmões (o sangue ainda não está oxigenado quando vai para o pulmão). Ocorre, portanto, hipoxemia, com redução da perfusão dos órgãos, ocasionando acidose e cianose.7 Uma diferença de saturação (cianose diferencial), maior em membros superiores do que em membros inferiores, em torno de 10%, é secundária ao shunt D-E pelo canal arterial. Nos recém-nascidos, em que o canal arterial se encontra fechado, o shunt pelo FOP causará cianose tanto nas extremidades superiores quanto nas inferiores. Devido à redução do fluxo sanguíneo pulmonar, também há alteração da relação ventilação/perfusão (V/Q). Outra característica clínica é a hipoxemia lábil, devido a mudanças grandes e súbitas na saturação de oxigênio após mudanças sutis na RVP e na RVS.7
A pós-carga elevada do VD ocasiona hipertrofia, dilatação e alteração da função ventricular direita. A HPPN causa um ciclo vicioso, pois a disfunção do VD diminui o fluxo sanguíneo pulmonar, piorando a hipoxemia.
Com base na fisiopatologia, a HPPN pode ser classificada da seguinte forma:8
- Má adaptação: ocorre em doenças parenquimatosas pulmonares (síndrome de aspiração meconial, síndrome de desconforto respiratório e pneumonia) e asfixia, que causam hipoxemia e vasoconstrição pulmonar. O aumento da idade gestacional e o sofrimento fetal estão associados a SAM. Acredita-se que a aspiração ocorra no útero, causando inflamação intensa e pneumonite química. Além disso, a inativação do surfactante e a obstrução mecânica pelo mecônio podem causar alteração da ventilação - perfusão secundária a atelectasia. Devido à vasoconstrição pulmonar in útero, pode haver remodelamento vascular pulmonar, resultando em HPPN. RN com pneumonia e sepse podem apresentar hipoxemia e acidose e hipertensão venosa pulmonar, que estão relacionadas à manutenção da elevada RVP. A SDR relacionada à prematuridade relacionada à deficiência de surfactante pode ser complicada pela HPPN.9
- Mau desenvolvimento: o remodelamento vascular pode ser secundário à hipoxemia intrauterina crônica. A HPPN idiopática ocorre em neonatos em qualquer doença parenquimatosa pulmonar. É caracterizada por remodelamento estrutural anormal das artérias pulmonares e hiperplasia das células musculares lisas pulmonares. O fechamento precoce do canal atrial, por uso de AINE no terceiro trimestre da gestação, é um dos exemplos dessa categoria, embora tal associação seja questionada.9
- Hiperdesenvolvimento: o hiperdesenvolvimento do parênquima pulmonar e da vasculatura pulmonar é frequentemente observado em neonatos com hérnia diafragmática congênita (HDC),10 malformação mais comum do diafragma. Na HDC, o grau de hipoplasia pulmonar e a HPPN estão diretamente relacionados à sobrevida,11 ruptura prolongada de membranas, oligodramnia e doenças renais, que também podem causar graus variáveis de hipoplasia pulmonar e HPPN.
- Obstrução intravascular: o aumento da viscosidade que ocorre na policitemia pode reduzir fornecimento de oxigênio aos tecidos e HPPN. A hipotermia terapêutica, realizada na encefalopatia hipóxico-isquêmica grave, também promove o aumento da viscosidade sanguínea, podendo ocasionar HPPN.12
5. ETIOLOGIA
5.1. Bases genéticas
Algumas crianças são geneticamente predispostas a desenvolver HPPN. Várias mutações genéticas, incluindo o gene que codifica o receptor 2 da proteína morfogênica óssea (BMPR2), foram identificadas na hipertensão arterial pulmonar hereditária (HAPH) e na hipertensão arterial pulmonar idiopática (HAPI), em adultos. As crianças portadoras desse gene têm menor probabilidade de responder ao teste com vasodilatador pulmonar e maior probabilidade de ter doença grave no momento do diagnóstico.13,14,15
Uma coorte francesa encontrou cinco mutações diferentes no BMPR2 em crianças com HAPI e HAPH, juntamente com outras mutações em ACVRL 1 TBX4.16 A presença de uma mutação no gene não garante que o paciente desenvolverá clinicamente a doença, o que sugere a contribuição da penetrância.16
Vários estudos in vitro e in vivo demonstraram que as mutações do BMPR2 diminuem a viabilidade das células endoteliais e levam à proliferação de Célula Muscular Lisa Arterial Pulmonar (PASMC), características principais da HAP. Várias alterações bioquímicas foram descritas em células com função diminuída do BMPR2, incluindo diminuição da função mitocondrial, aumento da glicólise e proliferação excessiva de PASMC. Foi relatado que a regulação negativa do BMPR2 contribui para a fisiopatologia da HAP em pacientes sem mutações específicas neste gene. O BMPR2 emergiu como uma importante via de sinalização que é alterada em uma variedade de casos de HAP, e as terapias para promover essa sinalização estão sendo ativamente estudadas como a próxima fronteira nas terapias específicas para HAP.17,18
Há descrição de outros genes como CAV1, KCNK3 e EIF2AK4 em adultos com HAP. No entanto, há menos informações sobre o papel desses genes na HPPN.1
5.2. Mecanismos moleculares
O avanço na compreensão dos mecanismos moleculares que regem essa patologia tem permitido o desenvolvimento de terapias mais direcionadas, visando não apenas o "alívio dos sintomas", mas a modulação dos processos patogênicos subjacentes. A seguir, são apresentados os principais mecanismos moleculares envolvidos na fisiopatologia da doença.18
5.2.1. Via óxido nítrico-guanilato ciclase- monofosfato guanosina cíclica (NO-sGC-cGMP)
O óxido nítrico (NO) é fundamental na regulação do tônus vascular, promovendo vasodilatação através da ativação da guanilato ciclase solúvel (sGC) e subsequente produção de monofosfato de guanosina cíclico (cGMP). A disfunção na produção ou sinalização de NO está diretamente relacionada à patogênese da hipertensão pulmonar (HP). Estudos demonstram que a redução da expressão da NO sintase endotelial (eNOS) e a diminuição da biodisponibilidade de NO resultam em vasoconstrição persistente e aumento da resistência vascular pulmonar.17,18
5.2.2. Prostaciclina e remodelamento vascular
A prostaciclina (PGI2) exerce efeitos antiproliferativos e vasodilatadores, sendo crucial na manutenção da homeostase vascular. Em modelos experimentais, a redução da atividade de enzimas como a cicloxigenase-2 (COX-2) foi associada ao agravamento da HP, sugerindo que a diminuição da produção de prostaciclina contribui significativamente para a disfunção endotelial e o remodelamento adverso dos vasos pulmonares.16,17,18
5.2.3. Endotelina-1: um potente vasoconstritor
A endotelina-1 (ET-1) é um dos mais potentes vasoconstritores conhecidos e desempenha papel central na patogênese da HP. A sinalização mediada por ET-1 promove a proliferação de células musculares lisas e a deposição de matriz extracelular, contribuindo para o espessamento da parede vascular e o aumento da resistência vascular. A modulação dessa via tem sido alvo de intervenções terapêuticas promissoras, na tentativa de mitigar os efeitos da hipertensão pulmonar.18
5.2.4. Espécies reativas de oxigênio e estresse oxidativo
O estresse oxidativo, mediado por espécies reativas de oxigênio (ROS), desempenha papel significativo na disfunção endotelial observada na HP. ROS não apenas inativam o NO, como promovem a proliferação das células musculares lisas, exacerbando o remodelamento vascular. A presença de altos níveis de superóxido e peróxido de hidrogênio (H2O2) tem sido consistentemente observada em modelos de HP, sendo estes fatores críticos no aumento da resistência vascular.17,18
5.2.5. Canais iônicos e a regulação do tônus vascular
As alterações na atividade dos canais de potássio (K) e cálcio (Ca) são determinantes na regulação do tônus muscular liso vascular na HP. A diminuição da expressão e funcionalidade desses canais resulta em despolarização das células musculares lisas e aumento do influxo de Ca2+, o que, por sua vez, leva a uma vasoconstrição exacerbada e ao remodelamento vascular associada à HP.16,17,18
5.2.6. Fatores de crescimento e remodelamento vascular
O fator de crescimento endotelial vascular (VEGF) e a via do receptor tipo 2 da proteína morfogenética óssea (BMPR2) são essenciais na regulação da angiogênese e remodelamento vascular. Em particular, mutações no gene BMPR2 estão fortemente associadas à forma hereditária de hipertensão pulmonar, na qual a proliferação celular aberrante e o remodelamento vascular são características predominantes. Além disso, níveis alterados de VEGF têm sido observados em modelos experimentais de HP, sugerindo que essa via pode ser um alvo terapêutico viável para intervenção precoce.16,17,18
6. DIAGNÓSTICO
A avaliação de pacientes com possível hipertensão pulmonar deve se concentrar em confirmar o diagnóstico, classificar a causa da hipertensão pulmonar e determinar a gravidade.19 É fundamental reconhecer que nem todos os recém-nascidos com insuficiência respiratória hipoxêmica aguda (IRHA) têm fisiologia da hipertensão pulmonar persistente. O diagnóstico no contexto de IRHA em neonatos a termo ou prematuros é confirmado mais comumente por evidência ecocardiográfica (ECO) de desvio shunt da direita para a esquerda e aumento dos gradientes pré- e pós-ductais em PaO2 ou saturação.20
A avaliação inicial da hipertensão pulmonar persistente do recém-nascido deve incluir história completa dos fatores de risco, exame físico, medição da saturação de oxigênio pré-ductal (membro superior direito) e pós-ductal (membro inferior). A hipoxemia é frequentemente lábil na hipertensão pulmonar do recém-nascido, ao contrário da hipoxemia fixa observada na doença cardíaca cianótica.21 A radiografia de tórax e a gasometria auxiliam no diagnóstico.
Sinais clínicos como estado mental, enchimento capilar e débito urinário são comprometidos durante fases tardias da hipoperfusão sistêmica. O monitoramento não invasivo do índice de perfusão (IP), oximetria de pulso (SpO2) e espectroscopia no infravermelho próximo (NIRS) pode detectar alterações na perfusão sistêmica. A análise de gases sanguíneos e o lactato sérico são mecanismos invasivos para avaliar a perfusão sistêmica.22 Dentre os principais exames complementares, destacamos:
6.1. Radiografia de tórax
A radiografia de tórax apresenta achados anormais na maioria dos pacientes com hipertensão pulmonar; no entanto, uma radiografia de tórax normal não a exclui. Os sinais radiográficos incluem uma configuração característica da silhueta cardíaca do coração direito (átrio direito AD/VD) e aumento do tronco da artéria pulmonar, às vezes com poda das veias periféricas.23
6.2. Gasometria arterial
Pacientes com HAP geralmente têm pressão parcial normal ou levemente reduzida de oxigênio arterial (PaO2). Redução grave de PaO2 pode levantar suspeita de forame restritivo, doença hepática, outras anormalidades com desvio da direita para a esquerda (por exemplo, defeito septal) ou condições associadas à baixa capacidade de difusão pulmonar para monóxido de carbono (DLCO). A pressão parcial de dióxido de carbono arterial (PaCO2) é tipicamente menor que o normal devido à hiperventilação alveolar.23 O aumento do lactato sérico, indicando hipoperfusão tecidual, também está presente na HPPN com repercussão sistêmica.
6.3. Ecocardiograma
O ecocardiograma é uma ferramenta diagnóstica essencial para identificar e gerenciar recém-nascidos com hipertensão pulmonar. Nem todos os recém-nascidos a termo com hipoxemia têm fisiologia de hipertensão pulmonar persistente do recém-nascido (HPPRN).24
A avaliação com ecocardiograma seriado pode ajudar na compreensão da evolução da fisiopatologia e da resposta à intervenção terapêutica. A avaliação ecocardiográfica e hemodinâmica pode ajudar no direcionamento de intervenções específicas e orientar a escolha do vasodilatador pulmonar e terapia vasoativa apropriadas.21
A avaliação ecocardiográfica descartará cardiopatias congênitas, como drenagem anômala total de veias pulmonares, coarctação grave da aorta e síndrome do coração esquerdo hipoplásico. Além disso, os estudos ecocardiográficos devem determinar a direção predominante do shunt no FOP, bem como no canal arterial.24 O ecocardiograma também é útil para a avaliação da função ventricular esquerda. Enquanto o desvio da direita para a esquerda no canal arterial e fossa oval é típico para hipertensão arterial pulmonar do recém-nascido, o desvio predominante da direita para a esquerda no canal arterial com desvio da esquerda para a direita na fossa oval sugere disfunção ventricular esquerda, que pode estar relacionada à fisiopatologia subjacente.24
7. TRATAMENTO
Com os avanços da medicina e o maior conhecimento sobre a fisiopatologia e o diagnóstico precoce da hipertensão pulmonar persistente do recém-nascido, o manejo do tratamento específico vem avançando. Os princípios básicos do tratamento são baseados na fisiopatologia da hipertensão pulmonar.
Uma estratégia básica, porém importante, para o tratamento da hipertensão pulmonar persistente do recém-nascido e lactentes, é a manutenção da temperatura corporal, eletrólitos (particularmente cálcio e magnésio, glicose) e volume intravascular. Além disso, a ventilação mecânica deve ser adequadamente fornecida, para melhorar a oxigenação e atingir volumes pulmonares normais.25 Além disso, é preciso manter uma boa homeostase com boa sedação e analgesia, quando necessário.
Terapias atuais para hipertensão pulmonar do recém-nascido visam três vias: estimular a via biológica do óxido nítrico-guanosina monofosfato cíclico, aumentar os efeitos da prostaciclina nos receptores e antagonizar a via da endotelina.19
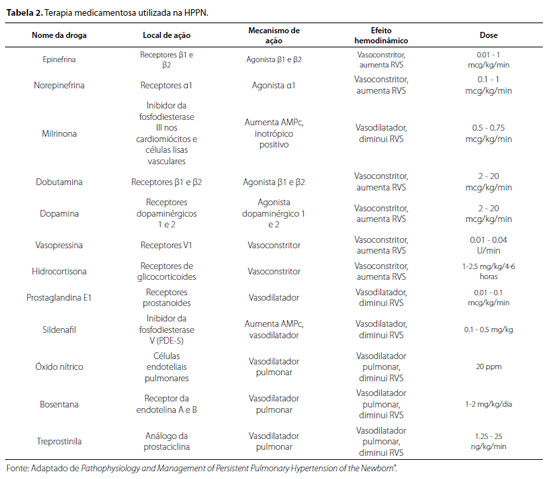
Terapias vasodilatadoras adicionais podem ser consideradas em um caso refratário de hipertensão pulmonar, e vários medicamentos indicados para a população adulta, incluindo sildenafil e bosentana, também foram usados em recém-nascidos.25,26 Tratamentos eficazes visam idealmente ao remodelamento das artérias pulmonares, bem como a vasoconstrição. A Tabela 2 apresenta os principais fármacos e seus mecanismos de ação na fisiopatologia da HPPN.
7.1. Oxigenioterapia
Como a administração de O2 é imperativa para a manutenção do metabolismo tecidual e tem efeitos vasodilatadores pulmonares, continua sendo a terapia de primeira linha para hipertensão pulmonar persistente do recém-nascido. O oxigênio causa vasodilatação pulmonar seletiva através da ativação direta de canais de K+ ativados por cálcio e aumento da produção de NO (óxido nítrico).20
Wung e colegas sugeriram que a ventilação suave, evitando a hiperóxia e a hiperventilação, resulta em bons resultados para neonatos com insuficiência respiratória. Com isso, após estudos em animais, concluiu-se que a hipoxemia resulta em vasoconstrição pulmonar, e a normoxemia reduz a resistência vascular pulmonar, mas a hiperóxia não aumenta a vasodilatação pulmonar.1
Estratégias de ventilação suaves com PEEP ideal, pressão de inflação de pico ou volume corrente relativamente baixo e um grau de hipercapnia permissiva são recomendadas para garantir a expansão pulmonar adequada, enquanto limita o barotrauma e o volutrauma.1
7.2. Óxido nítrico inalado
O óxido nítrico inalado (iNO) é uma das terapias mais usadas para tratar a hipertensão pulmonar. Foi aprovado pelo FDA em 1999, como uma terapia vasodilatadora pulmonar para o tratamento da hipertensão pulmonar persistente em bebês a termo e quase a termo, com base em dois ensaios clínicos randomizados controlados por placebo multicêntricos de referência que mostraram diminuição significativa na necessidade de oxigenação por membrana extracorpórea (ECMO) no grupo iNO.20
O óxido nítrico (NO) produzido pelo endotélio estimula a guanilil ciclase solúvel (sGC) na célula muscular lisa arterial pulmonar (PASMC) a produzir cGMP. Tanto o NO quanto o cGMP, produzem vasodilatação pulmonar.1 O NO pode atravessar a membrana alvéolo-capilar para entrar nos músculos lisos das arteríolas pulmonares pré-capilares, causando vasodilatação seletiva e atenuação do remodelamento vascular.1,20 Ele é administrado como um gás inalado misturado com ar ou oxigênio e simula a ação do NO endógeno para ativar a sGC nas células musculares lisas da artéria pulmonar, levando ao aumento dos níveis de cGMP e à vasodilatação.
O iNO tem uma meia-vida relativamente curta, de 15 a 30s, e é rapidamente metabolizado na circulação pulmonar, prevenindo seus efeitos sistêmicos. O uso crônico de iNO está associado à metemoglobinemia e, portanto, os níveis de metemoglobina devem ser monitorados nesses pacientes. O iNO geralmente é iniciado em uma dose de 20 partes por milhão (ppm), independentemente da etiologia. Doses mais altas não melhoram a oxigenação e contribuem para o aumento dos riscos de metemoglobinemia e exposição ao dióxido de nitrogênio. Uma vez que a oxigenação melhora, a dose de iNO pode ser rapidamente reduzida em etapas antes da descontinuação. Há relatos de hipertensão pulmonar de rebote com risco de vida após a descontinuação, e isso geralmente pode ser evitado pelo desmame lento.20
7.3. Sildenafil
O aumento da atividade da fosfodiesterase 5 (PDE5) resulta no catabolismo do cGMP e na limitação da vasodilatação induzida por NO. Portanto, a inibição da PDE5 com o uso de sildenafil é uma estratégia promissora no tratamento da hipertensão pulmonar do recém-nascido.21
Foi demonstrado que o sildenafil é benéfico para tratar bebês com hipertensão pulmonar grave que não responderam totalmente ao iNO ou se o iNO não estiver disponível. Estudos demonstraram que o sildenafil intravenoso é eficaz para melhorar a oxigenação em pacientes com hipertensão pulmonar persistente do recém-nascido, independentemente de sua exposição ao iNO, e pode diminuir a hipertensão pulmonar de rebote, que pode ser vista durante o desmame do iNO.24
O sildenafil oral tem sido usado em bebês com hipertensão pulmonar prolongada associada à displasia broncopulmonar (DBP), sendo o esteio do tratamento em crianças com hipertensão pulmonar crônica.
7.4. Prostacilina
A prostaciclina, uma prostaglandina natural, é um vasodilatador potente com efeitos antitrombóticos, antiproliferativos e anti-inflamatórios.27 A prostaciclina I2 (PGI2) medeia a vasodilatação, ativando a adenilato ciclase e aumentando o AMPc na célula muscular lisa arterial pulmonar (PASMC).21
Estudos sugerem que a PGI2 intratraqueal ou em aerossol pode melhorar a oxigenação e parece bem tolerada em neonatos com hipertensão pulmonar persistente do recém-nascido refratária. No entanto; no recém-nascido gravemente doente, o uso de PGI2 inalado tem sido limitado devido a problemas com administração inconsistente, irritação das vias aéreas e broncoconstrição. Novos análogos e preparações de PGE2 estão surgindo como possíveis opções terapêuticas, especialmente em hipertensão pulmonar persistente do recém-nascido grave ou hipertensão pulmonar associada a doenças pulmonares de desenvolvimento, incluindo epoprostenol IV (Flolan®), Iloprost inalado intermitentemente (Ventavis®) e Treprostinil (Remodulin®) administrado por via subcutânea ou IV. (14)
Treprostinil é um análogo sintético da prostaciclina que estimula a adenilil ciclase em células musculares lisas vasculares, levando a níveis aumentados de AMP cíclico intracelular e subsequente vasodilatação nos sistemas circulatórios sistêmico e pulmonar. O medicamento pode ser administrado parenteralmente e, portanto, pode ser útil como uma terapia complementar para casos intratáveis envolvendo recém-nascidos que não toleram alimentação enteral.25
Iloprost é um análogo da prostaciclina com maior estabilidade química, o que o torna prático para fins de tratamento. Iloprost inalado é sugerido, na literatura, como terapia única ou adjuvante. Está prontamente disponível e tem efeitos clínicos comparáveis ao iNO, embora ainda precise de mais ensaios clínicos para mostrar sua eficácia. No entanto, Iloprost inalado provou ser uma alternativa confiável quando o iNO não está disponível, e pode ser usado como terapia adjuvante junto com vasodilatadores pulmonares (27).
7.5. Antagonistas das endotelinas
Endotelina 1 é um potente vasoconstritor endógeno, com expressão exacerbada em pacientes com hipertensão pulmonar persistente. Seus antagonistas bloqueiam sua atividade. É assim que bosentana e ambrisentana funcionam.19 No entanto, bosentana tem eficácia variável devido à absorção intestinal inconsistente.
7.6. Milrinona
Milrinona é um inibidor de PDE3 que leva ao aumento dos níveis de AMPc em PASMCs e da vasodilatação, além de ter efeitos notrópicos e lusitrópicos, contribuindo, assim, para o relaxamento miocárdico. Milrinona é uma opção terapêutica eficaz em lactentes com HPPRN, particularmente se iNO resistente ou na presença de disfunção cardíaca, considerando seus efeitos adjuvantes no miocárdio. Talvez sua maior utilidade esteja no cenário de HPPRN com disfunção do VE, no qual a resistência vascular sistêmica reduzida com milrinona pode melhorar o desempenho do VE e diminuir a pressão venosa pulmonar, podendo reduzir o desvio do fluxo sanguíneo da direita para a esquerda em nível atrial.28
7.7. ECMO
A oxigenação por membrana extracorpórea (ECMO) fornece tempo para "recuperação" da função pulmonar e cardíaca. Seu uso diminuiu após a adoção de melhorias nas estratégias de ventilação mecânica e vasodilatação pulmonar. No entanto, a ECMO continua sendo uma estratégia de resgate eficaz e potencialmente salvadora para bebês com HPPRN.20
O suporte circulatório mecânico se tornou uma ferramenta de ligação estabelecida para o transplante em doentes com insuficiência cardíaca direita irreversível, mas é ocasionalmente utilizado como ponte para a recuperação em doentes com causas tratáveis e insuficiência do ventrículo direito potencialmente reversível. Não podem ser feitas recomendações gerais relativas à indicação de suporte circulatório mecânico, que necessita ser individualizado, considerando fatores do paciente e recursos locais.19
Deve-se "discutir" a possibilidade de ECMO precocemente, sobretudo naqueles não respondedores ao óxido nítrico inalado, ou naqueles que não melhoram apesar de toda terapia convencional oferecida.21,29
A hipotensão em paciente criticamente enfermos com hipertensão pulmonar do recém-nascido deve ser imediatamente tratada com medicamentos vasoativos, como epinefrina, norepinefrina, dobutamina, a fim de elevar a pressão arterial sistêmica a ponto de melhorar a perfusão sistêmica. Consequentemente, haverá uma tendência na inversão do shunt pelo canal arterial. Isso aumentará o fluxo sanguíneo pulmonar (e, consequentemente, a oxigenação e perfusão sistêmica e pulmonar), aumentando o débito cardíaco do ventrículo esquerdo.21
A hipotensão refratária, associadaà disfunção cardíaca, pode levar à rápida deterioração com instabilidade hemodinâmica e à canulação para ECMO.21,30
8. CONCLUSÕES
Houve ganho substancial na compreensão da fisiopatologia da HPPN nas últimas décadas. O conhecimento das vias bioquímicas responsáveis pela vasoconstrição anormal da vasculatura pulmonar são agora mais bem entendidas, o que pode direcionar de maneira mais eficaz o tratamento desses pacientes. O ecocardiograma à beira de leito, além de estabelecer o diagnóstico precoce, proporciona a compreensão da fisiopatologia e das alterações hemodinâmicas da doença e das respostas à intervenção terapêutica.
Os vasodilatadores pulmonares mais recentes, como os antioxidantes, os ativadores solúveis da guanilato ciclase e os inibidores da rho-quinase, são promissores, mas ainda estão sob investigação e atualmente seu uso é limitado à pesquisa. Eles podem desempenhar papel importante no tratamento desses pacientes, sobretudo nos casos refratários ao uso de óxido nítrico.
9. REFERÊNCIAS
1. Sankaran D, Lakshminrusimha S. Pulmonary hypertension in the newborn - etiology and pathogenesis. Semin Fetal Neonatal Med. 2022 Aug;27(4):101381. doi: 10.1016/j.siny.2022.101381
2. Martinho S, Adão R, Leite-Moreira AF and Brás-Silva C. Persistent Pulmonary Hypertension of the Newborn: Pathophysiological Mechanisms and Novel Therapeutic Approaches. Front Pediatr 2020; 8: 342
3. Steurer MA, Jelliffe-Pawlowski LL, Baer RJ, Partridge JC, Rogers EE, Keller RL. Persistent Pulmonary Hypertension of the Newborn in Late Preterm and Term Infants in California. Pediatrics. 2017 1;139(1):e20161165
4. Rasanen J, Wood DC, Weiner S, Ludomirski A, Huhta JC. Role of the pulmonary circulation in the distribution of human fetal cardiac output during the second half of pregnancy. Circulation 1996;94:1068-73.
5. Rudolph AM. Aortopulmonary transposition in the fetus: speculation on pathophysiology and herapy. Pediatr Res 2007;61:375-80.
6. Lakshminrusimha S, Steinhorn RH. 155 - pathophysiology of persistent pulmonary hypertension of the newborn. In: Polin RA, Abman SH, Rowitch DH, Benitz WE, Fox WW, editors. Fetal and neonatal physiology. fifth ed. Elsevier; 2017. 1576-1588.e4.
7. Lakshminrusimha S, KeszlerM. Persistent pulmonary hypertension of the newborn. NeoReviews 2015;16:e680-92.
8. Sharma V, Berkelhamer S, Lakshminrusimha S. Persistent pulmonary hypertension of the newborn. Matern Health Neonatol Perinatol 2015;1:14.
9. Van Marter LJ, Hernandez-Diaz S, Werler MM, Louik C, Mitchell AA. Nonsteroidal antiinflammatory drugs in late pregnancy and persistent pulmonary hypertension of the newborn.Pediatrics 2013;131:79-87.
10. Chandrasekharan PK, Rawat M, Madappa R, Rothstein DH, Lakshminrusimha S. Congenital Diaphragmatic hernia - a review. Matern Health Neonatol Perinatol 2017;3:6.
11. Kosiński P, Wielgoś M. Congenital diaphragmatic hernia: pathogenesis, prenatal diagnosis and management - literature review. Ginekol Pol. 2017;88(1):24-30. doi: 10.5603/GP.a2017.0005
12. Hedrick HL, Danzer E, Merchant A, Bebbington MW, Zhao H, Flake AW et al. Liver position and lung-to-head ratio for prediction of extracorporeal membrane oxygenation and survival in isolated left congenital diaphragmatic hernia. Am JObstet Gynecol 2007;197:422. e1-. e4.
13. Atkinson C, Stewart S, Upton PD, Machado R, Thomson JR, Trembath RC, Morrell NW. Primary pulmonary hypertension is associated with reduced pulmonary vascular expression of type II bone morphogenetic protein receptor. Circulation 105: 1672-1678, 2002.
14. Deng Z, Morse JH, Slager SL, Cuervo N, Moore KJ, Venetos G, Kalachikov S, Cayanis E, Fischer SG, Barst RJ, Hodge SE, Knowles JA. Familial primary pulmonary hypertension (gene PPH1) is caused by mutations in the bone morphogenetic protein receptor-II gene. Am J Hum Genet 67: 737-744, 2000.
15. Kinsella JP. Inhaled nitric oxide therapy in premature newborns. Curr Opin Pediatr 18: 107-111, 2006.
16. Levy M, Eyries M, Szezepanski I, Ladouceur M, Nadaud S, Bonnet D, Soubrier F. Genetic analyses in a cohort of children with pulmonary hypertension. Eur Respir J 48: 1118-1126,2016.
17. Rabinovitch M Molecular pathogenesis of pulmonary arterial hypertension. J Clin Invest 122: 4306-4313, 2012.
18. West J, Austin E, Fessel JP, Loyd J, Hamid R. Rescuing the BMPR2 signaling axis in pulmonary arterial hypertension. Drug Discov Today 19: 1241-1245, 2014.
19. Ruopp NF, Cockrill BA. Diagnosis and Treatment of Pulmonary Arterial Hypertension: A Review. JAMA. 2022 Apr 12;327(14):1379-1391. doi: 10.1001/jama.2022.4402. Erratum in: JAMA. 2022 Sep 6;328(9):892. doi: 10.1001/jama.2022.13696.
20. Mukherjee D, Konduri GG. Pediatric Pulmonary Hypertension: Definitions, Mechanisms, Diagnosis, and Treatment. Compr Physiol. 2021 Jun 30;11(3):2135-2190. doi: 10.1002/cphy.c200023. PMID: 34190343
21. Singh Y, Lakshminrusimha S. Pathophysiology and Management of Persistent Pulmonary Hypertension of the Newborn. Clin Perinatol. 2021 Aug;48(3):595-618. doi: 10.1016/j.clp.2021.05.009
22. Siefkes HM, Lakshminrusimha S. Management of systemic hypotension in term infants with persistent pulmonary hypertension of the newborn: an illustrated review. Arch Dis Child Fetal Neonatal Ed. 2021 Jul;106(4):446-455. doi: 10.1136/archdischild-2020-319705. Epub 2021 Jan 21.
23. Humbert M, Kovacs G, Hoeper MM, Badagliacca R, Berger RMF, Brida M, Carlsen J, Coats AJS, Escribano-Subias P, Ferrari P, Ferreira DS, Ghofrani HA, Giannakoulas G, Kiely DG, Mayer E, Meszaros G, Nagavci B, Olsson KM, Pepke-Zaba J, Quint JK, Rådegran G, Simonneau G, Sitbon O, Tonia T, Toshner M, Vachiery JL, Vonk Noordegraaf A, Delcroix M, Rosenkranz S; ESC/ERS Scientific Document Group. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J. 2023 Jan 6;61(1):2200879. doi: 10.1183/13993003.00879-2022
24. Mandell E, Kinsella JP, Abman SH. Persistent pulmonary hypertension of the newborn. Pediatr Pulmonol. 2021 Mar;56(3):661-669. doi: 10.1002/ppul.25073
25. Kim YJ, Shin SH, Kim EK, Kim HS. Short term effect of intravenous treprostinil in term and preterm infants with pulmonary hypertension. BMC Pediatric. 2024 Jan 29;24(1):83. doi: 10.1186/s12887-023-04501-4
26. Cookson MW, Abman SH, Kinsella JP, Mandell EW. Pulmonary vasodilator strategies in neonates with acute hypoxemic respiratory failure and pulmonary hypertension. Semin Fetal Neonatal Med. 2022 Aug;27(4):101367. doi: 10.1016/j.siny.2022.101367. Epub 2022 Jun 3
27. Yıldırım Ş. Inhaled iloprost is an effective alternative therapy for persistent pulmonary hypertension in newborns. Pulm Circ. 2023 Jul 18;13(3):e12268. doi: 10.1002/pul2.12268.
28. Martinho S, Adão R, Leite-Moreira AF, Brás-Silva C. Persistent Pulmonary Hypertension of the Newborn: Pathophysiological Mechanisms and Novel Therapeutic Approaches. Front Pediatr. 2020 Jul 24;8:342. doi: 10.3389/fped.2020.00342.
29. Olicker AL, Raffay TM, Ryan RM. Neonatal Respiratory Distress Secondary to Meconium Aspiration Syndrome. Children (Basel). 2021 Mar 23;8(3):246. doi:10.3390/children8030246
30. Kim F, Bernbaum J, Connelly J, Gerdes M, Hedrick HL, Hoffman C, Rintoul NE, Ziolkowski K, DeMauro SB. Survival and Developmental Outcomes of Neonates Treated with Extracorporeal Membrane Oxygenation: A 10-Year Single-Center Experience. J Pediatr. 2021 Feb;229:134-140.e3. doi: 10.1016/j.jpeds.2020.10.011. Epub 2020 Oct 13