Número atual: 23(1) - Março 2023
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisao
Mitigação de sintomas do transtorno Do espectro autista através do uso de abordagens nutricionais específicas: uma revisão de escopo
Autism spectrum disorder symptoms mitigation through the use of specific nutritional approaches: a scope review
Luisa Corte Real1; Luiza Lemos Ramos1; Jaime Lin2; Maiara de Aguiar da-Costa2; Victória Linden de-Rezende2; Cinara Ludvig Gonçalves2
DOI:10.31365/issn.2595-1769.v23i1p17-25
1. Universidade Federal de Santa Catarina, - Araranguá - Santa Catarina - Brasil
2. Universidade do Extremo Sul de Santa Catarina, Laboratório de Pesquisa em Autismo e Neurodesenvolvimento, Programa de Pós-Graduação em Ciências da Saúde - Criciúma - Santa Catarina - Brasil
Endereço para correspondência:
Jaime Lin
linjaime1407@gmail.com
Instituição: Universidade do Extremo Sul de Santa Catarina, Laboratório de Pesquisa em Autismo e Neurodesenvolvimento, Programa de Pós Graduação em Ciências da Saúde - Criciúma - Santa Catarina - Brasil
Recebido em: 09/11/2021
Aprovado em: 12/05/2023
Resumo
INTRODUÇÃO: O transtorno do espectro autista é uma desordem do neurodesenvolvimento e, de acordo com o DSM-5, caracteriza-se por um déficit de comunicação social e padrões repetitivos e/ou restritos de comportamento. Cada vez mais, têm-se relacionado o transtorno do espectro autista a certos padrões e hábitos alimentares, optando-se, em grande parte do tempo, por alimentos ricos em gordura, calorias e poucos nutrientes.
OBJETIVO: Analisar e discutir os achados mais significativos acerca da mitigação dos sintomas do transtorno do espectro autista através de abordagens nutricionais específicas.
FONTE DOS DADOS: Foi realizada revisão de literatura dos últimos dois anos de acordo com a metodologia de scoping review (revisão de escopo), seguindo as bases de dados Biblioteca Virtual em Saúde, PubMed e Scielo, e utilizando os descritores: “Nutritional Status” OR Diet AND “Autism Spectrum Disorder””. Ao final do processo de seleção, restaram 19 artigos. Síntese dos dados: Há uma relação particular entre o alimento e o indivíduo com transtorno do espectro autista, com comprovada seletividade nutricional. Além disso, esta revisão concluiu resultados positivos quanto à melhora dos sintomas dessa desordem durante a utilização de determinados pré e probióticos. Por fim, em se tratando de suplementação vitamínica e dietas específicas (cetogênica e livre de glúten e caseína), os resultados foram inconclusivos.
CONCLUSÃO: Ensaios clínicos randomizados mais robustos e rigorosos devem ser realizados a fim de se estabelecer o real efeito do uso de dietas específicas na mitigação de sintomas do transtorno do espectro autista.
Palavras-chave: Dieta. Transtorno de Espectro Autista. Estado Nutricional.
Abstract
INTRODUCTION: The autism spectrum disorder is a neurodevelopmental disorder and, according to DSM-5, it is characterized by social communication deficit and repetitive and/or restrictive behavior patterns. Autism spectrum disorder has been related with certain eating patterns and habits, choosing, in most of the time, for fatty, hypercaloric, sodium rich and non-nutritive food.
OBJECTIVE: To analyze and discuss the most significant findings over autism spectrum disorder symptoms mitigation through specific nutritional approaches.
DATA SOURCES: A literature review, from the last 2 years, was carried out following the scoping review methodology and Virtual Health Library, PubMed and Scielo databases. The following descriptors were used: “Nutritional Status” OR Diet AND “Autism Spectrum Disorder”. At the end of the selection process, 19 articles remained to be analyzed.
DATA SYNTHESIS: There is an intimate relation between autism spectrum disorder patients and a proven food selectivity. This review found positive results regarding symptoms mitigation during pre and probiotics use. When it comes to vitamin supplementation and specific diets (ketogenic, gluten and casein free), results were inconclusive.
CONCLUSION: Wider and more rigorous clinical trials are necessary to establish the real effect that specific diets have on autism spectrum disorder symptoms mitigation.
Keywords: Nutritional Status. Diet. Autism Spectrum Disorder.
Introdução
Quando descrito a primeira vez por Leo Kanner, em 1943, o autismo era considerado uma disfunção de ordem do neurodesenvolvimento, tendo essas crianças uma inabilidade não usual de manter contato com outras pessoas, o que afeta gravemente suas habilidades sociais. Embora sua etiologia seja vista como incerta, relações com fatores ambientais e genéticos são estabelecidos.1
Atualmente, o transtorno do espectro autista (TEA), que congrega os anteriormente descritos pelo DSM-IV, transtornos autista, de Asperger e global do desenvolvimento, é descrito como uma patologia de ordem psiquiátrica e neurológica, caracterizada por déficits persistentes na comunicação e na interação social em múltiplos contextos. Incluem-se déficits na reciprocidade socioemocional, nos comportamentos comunicativos não verbais usados para interação social e para desenvolver, manter e compreender relacionamentos, além de padrões restritos e repetitivos de comportamento,2 interesses ou atividades, como insistência nas mesmas coisas, adesão inflexível a rotinas ou padrões ritualizados de comportamento verbal ou não verbal, interesses fixos e altamente restritos que são anormais em intensidade ou foco, hiper ou hiporreatividade a estímulos sensoriais e interesse incomum por aspectos sensoriais do ambiente.3, 4, 5, 6
Aponta-se que cerca de 1% de pessoas da população mundial possua TEA e sua incidência é maior em indivíduos do sexo masculino do que do feminino, com uma razão de quatro homens para cada mulher (4:1).7 Embora não haja estimativas confiáveis da prevalência brasileira, seguindo-se estudos internacionais que apontam que 1% das crianças são portadoras de autismo, é concebível que cerca de 1,5 milhão de brasileiros tivessem TEA em 2010.7
A preocupação com dietas específicas para pacientes com TEA surge quando uma forte relação entre autismo, sedentarismo e hábitos alimentares restritos e peculiares culminam, em muitos casos, em uma dieta baseada em alimentos hipercalóricos, gordurosos, não nutritivos e ricos em sódio.8,9 Evidências fisiopatológicas apontam para um estado hiperinflamatório sistêmico, modificações intestinais e altas concentrações de aminoácidos e peptídeos alimentares encontrados na circulação sanguínea, urinária e líquido cefalorraquidiano de pessoas autistas, corroborando a tese de que esses pacientes sofrem com o processo de metabolização deficiente de tais substâncias.3
Dentre as dietas específicas sugeridas, encontram-se métodos livres de glúten e/ou caseína,10,11,12,13,14 restrições ao uso de carboidratos,6,8 uso de vitaminas e suplementos minerais,15,16,17 enzimas digestivas18 e administração de pré e probióticos,19,20,21,22,23,24,25 com o intuito de atenuar desfechos comportamentais e intelectuais negativos.26
Metodologia
O presente estudo realizou uma revisão de literatura em bases de dados nacionais e internacionais a partir da metodologia scopingreview (revisão de escopo), cuja técnica se baseia em mapear, analisar e sintetizar os conhecimentos até então existentes acerca de determinado assunto e com isso identificar lacunas existentes.27
A pergunta norteadora da pesquisa foi: “qual a efetividade das intervenções nutricionais na terapêutica dos transtornos do espectro autista?”. As etapas metodológicas do estudo são: (1) definir os descritores de busca com base no site http://decs.bvs.br/; (2) pesquisar nas bases de dados “Biblioteca Virtual em Saúde”, “Pubmed” e “Scielo”; (3) ler os títulos e resumos encontrados para realizar a primeira seleção; (4) sumarizar e analisar criticamente os estudos selecionados; (5) aplicar os segundos critérios de seleção; (6) sintetizar, apresentar e discutir os principais resultados encontrados com base nos estudos selecionados.
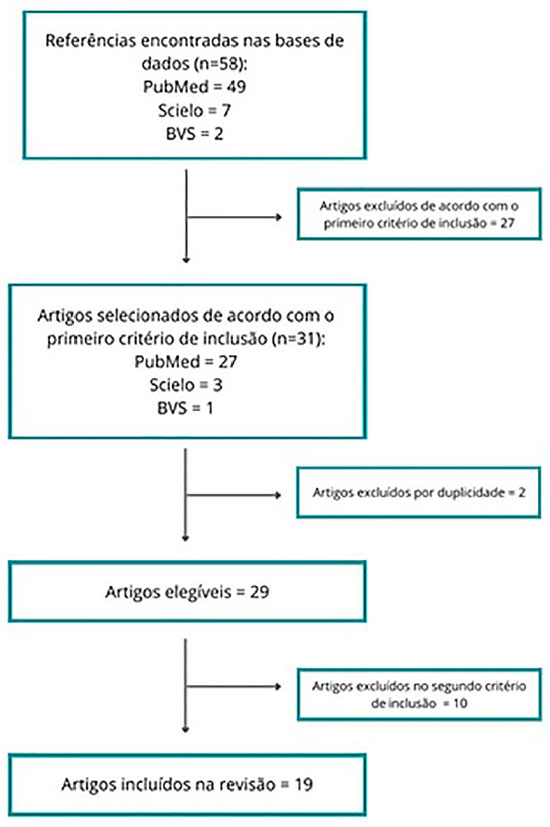
O levantamento bibliográfico foi feito com base nos descritores selecionados, utilizando a chave de busca ““NutritionalStatus” or Diet and “AutismSpectrumDisorder””. Restringiram-se os artigos utilizando filtros para estudos publicados nos últimos cinco anos (entre 2016 e 2021). Com base nessas delimitações, foram encontrados um total de 58 artigos, sendo 49 no PubMed, 7 na Scielo e 2 na BVS (Figura 1).
Os critérios de inclusão foram: (1) artigos que envolviam mutuamente o tema” nutrição e transtorno do espectro autista”; (2) artigos escritos em português, espanhol ou inglês; e (3) pesquisas disponíveis na íntegra. No segundo momento da seleção, optou-se por artigos que fossem: (a) revisões sistemáticas; (b) ensaios clínicos; e (c) artigos de revisão não sistemática; e publicados nos últimos dois anos (2019 a 2021), com o intuito de restringir os achados de revisões não sistemáticas às mais recentes publicações acerca do assunto. Logo, como representado na Figura 1, restaram 19 artigos para serem analisados na presente revisão de escopo.
Resultados e comentários
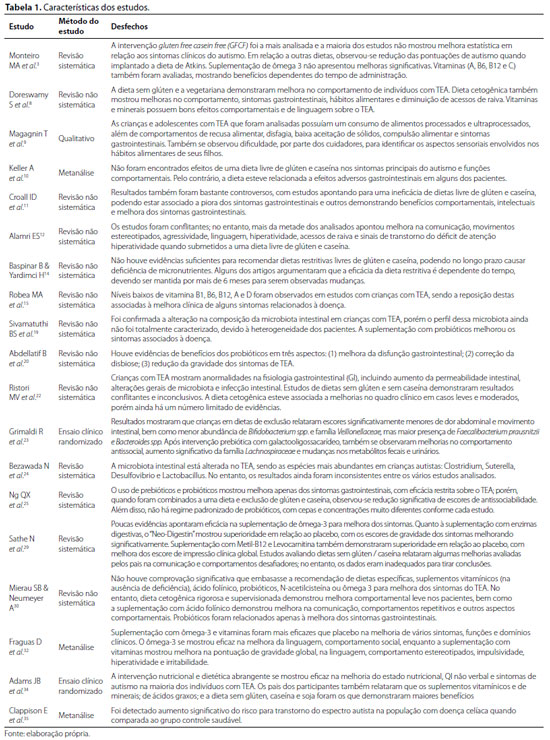
Analisando os resultados deste artigo, pode-se constatar que dentre os 19 estudos selecionados, 18 foram publicados em inglês (94,7%), enquanto apenas um foi escrito em português (5,3%) e nenhum em espanhol. A metodologia mais prevalente foi a revisão de literatura não sistemática (47,4%), seguida pela revisão sistemática ou metanálise (36,8%), ensaio clínico randomizado (10,5%) e, por fim, estudo qualitativo (5,3%). Na Tabela 1, é possível verificar os principais resultados sintetizados de cada estudo.
O conteúdo dos artigos revisados pode ser dividido em diversos campos, sendo as principais e mais recorrentes perspectivas estudadas o uso de probióticos, uso de suplementação vitamínica, outras suplementações e algumas dietas específicas, como as cetogênicas ou livres de glúten e caseína, visando a uma análise sobre a efetividade dessas intervenções nutricionais na atenuação dos aspectos clínicos dos transtornos do espectro autista. Portanto, compilamos o conhecimento aqui exposto dentro de quatro principais campos, adicionados a um campo geral, que discute as principais alterações de comportamento nutricional na doença.
Comportamento nutricional no TEA
Indivíduos com TEA tendem a apresentar problemas nutricionais devido a disfunções no seu sistema digestivo e por ingestão deficiente de vários nutrientes, com falta de fibras dietéticas, vitaminas, ferro, cálcio e potássio corroborando para que muitas crianças estejam abaixo do peso.9,29 Da mesma maneira, crianças autistas são consideradas “comedoras exigentes” e possuem alta seletividade alimentar para alimentos pobres em nutrientes, mas ricos em calorias, como amido, gorduras e alimentos processados, podendo também estar sujeitas a uma incidência de obesidade maior que em crianças não autistas.10,19,20 Nesse contexto, em um dos resultados analisados por Robea et al., foi possível constatar que crianças mais velhas com TEA, dentre uma população de 2 a 18 anos, tendiam ao sobrepeso, enquanto as mais jovens costumam estar abaixo do peso.15
As descrições acerca do comportamento desses indivíduos atentam para a presença de sensibilidades sensoriais específicas que os levam a optar por certos tipos de alimentos menos “saudáveis”. Crianças com TEA possuem uma relação modificada de intimidade com o alimento através da sua textura, aparência, cor, paladar, temperatura e olfato.10,24 Igualmente, parece haver influência na maneira como a comida é apresentada e os utensílios de louça utilizados.28 Assim, essa severidade de recusa e a persistência de certos alimentos se deve à excitação de sensibilidades específicas que são acionadas na neuropatologia da doença, enquadrando-se na rigidez comportamental típica do autismo.8,9 Além disso, a seletividade parece exacerbar sintomas gastrointestinais deletérios às crianças com TEA, com a ingesta de alimentos ricos em carboidratos e pobres em fibras.8,9
Baspinar & Yardimci discutem que todos os problemas nutricionais podem advir de outros distúrbios de base, como intolerâncias alimentares biológicas, problemas comportamentais, obsessão por detalhes, medo de inovação, privação sensorial e propensão a situações difíceis.14
Uso de probióticos
Conforme teorias acerca da influência do eixo cérebro-intestino na fisiopatologia do TEA, alguns dos estudos analisaram a influência de cepas probióticas tanto na atenuação de queixas intestinais, quanto no quadro clínico da doença. Uma das hipóteses sugere que tais indivíduos teriam um aumento da permeabilidade intestinal, corroborando a translocação bacteriana, formação de metabólitos e circulação sistêmica de substâncias não benéficas ao organismo.22 Essa disfunção contribuiria para um estado inflamatório que atingiria o sistema nervoso central, fortalecendo o estado patológico do autismo. Ainda, a modificação da microbiota parece reduzir a expressão de fatores neurotróficos, ocitocina e vasopressina.22 Assim, presume-se que os probióticos ajudariam a melhorar esse ciclo através da redução da permeabilidade da barreira intestinal, da redução das citocinas inflamatórias e outros efeitos imunomoduladores.24
Em um ensaio clínico randomizado com 30 crianças autistas, conduzido por Grimaldi et al.,23 foram observados grandes efeitos dos prebióticos na melhora da funcionalidade gastrointestinal, com alteração da microbiota, diminuição do desconforto GI dos pacientes e melhora da consistência das fezes. Em uma revisão sistemática que avaliou oito ensaios clínicos, o comportamento também apresentou melhora significativa, com importante diminuição da gravidade dos sintomas, especialmente de hiperatividade, desatenção e antissociabilidade, quando associados a dietas com exclusão de glúten e caseína.25 Dessa forma, estudos comprovaram uma forte correlação entre a gravidade do TEA e as disfunções do trato GI. Ainda, após suplementação, observou-se diminuição do padrão inflamatório local, com redução do marcador TNFα.8 Por fim, Grimaldi et al.23 observaram que o uso de probióticos como adicionais a dietas específicas, como as livres de glúten e caseína, potencializa a ação benéfica sobre os sintomas do TEA, com redução dos escores de antissociabilidade.
Em se tratando da microbiota específica de indivíduos autistas, parece haver predominância das espécies Clostridium,Suterella,Lactobacillus e Desulfovibrio.24 Porém, ainda não há concordância entre os estudos, havendo variações dos resultados a depender do ensaio clínico, sendo que alguns apontam para uma maior variedade de espécies e outros inicam o contrário, alegando uma falta de microrganismos reguladores do eixo cérebro-intestino.19,20,21,22,23,24,25 Para aqueles que acreditam haver excesso de bactérias, os probióticos aparentemente ajudariam a reduzir essa flora bacteriana, regulando a disbiose e diminuindo os sintomas nocivos ao TGI.24
Ao fazer a escolha do probiótico, revisões sugeriram que cepas anaeróbias apresentam maiores benefícios, pois as aeróbias têm curta duração e fazem parte de uma minoria da flora intestinal. Além disso, os mecanismos de ação mais bem-sucedidos de probióticos tendem a ser aqueles que incluem excreção de ácidos (lactato e acetato), competição por nutrientes e sítios receptores intestinais, imunomodulação e formação de agentes antimicrobianos específicos.24
Suplementação vitamínica
Como citado anteriormente, indivíduos com TEA possuem rigorosa seletividade alimentar, assim como defeitos na digestão e absorção dos mesmos. Ainda, os alimentos preferidos por eles tendem a ser pobres em nutrientes e fibras.29 Assim, muitos estudos mostraram forte tendência a um déficit nutricional, incluindo deficiência de vitaminas.
Uma das revisões analisadas expôs que no TEA há particular deficiência de cálcio, ferro, zinco, potássio, cobre, vitamina A, vitamina D, vitamina E, vitamina C, riboflavina, vitamina B12, ácido fólico e colina.10 Porém, a discussão em alta e ainda sem consenso é acerca da suplementação global desses compostos como forma de auxiliar no aprimoramento da função intestinal e dos sintomas de pacientes com TEA.
Profissionais que optam pela abordagem de suplementar vitaminas muitas vezes embasam sua conduta na explicação fisiopatológica de que o defeito no sistema antioxidante afeta a função cerebral e perturba o sistema imunológico. Assim, a suplementação de antioxidantes, como vitaminas, amenizaria os sintomas associados à doença.8,12 Nesse sentido, várias pesquisas vêm sendo realizadas, mas os resultados ainda são muito divergentes entre si, já sendo comprovado que o tempo de suplementação e a dose influenciam na eficácia dessa abordagem.10
Monteiro et al. descreveram alguns estudos que não resultaram na diferença entre suplementação vitamínica e placebo.3 Já Sathe et al. verificaram melhora significativa dos escores de impressão clínica global durante a suplementação de metil B12, porém sem grandes diferenças nas medidas de comportamento ou comunicação.29 Na revisão de Mierau & Neumeyer, constatou-se melhora dos sintomas gerais após administração de vitamina D, porém foi levantada a dúvida sobre essa análise, pois grande parte da população apresenta deficiência dessa vitamina em específico, sendo improvável que a melhora observada seja somente para o TEA.30 Nessa mesma revisão, o ácido fólico (forma reduzida do folato que atravessa a barreira hematoencefálica) mostrou-se responsável, em altas doses, pela melhora da comunicação e comportamentos repetitivos no TEA.30
Dentre todos os artigos analisados nesta revisão, pode-se concluir que a suplementação com vitaminas do complexo B e a vitamina D foram as que mais se mostraram eficazes na atenuação de sintomas, com evidências de melhora também em escores clínicos da doença.19,20,22 De igual maneira, o período de administração das vitaminas maior que seis meses também teve influência direta positiva nos resultados.10
Outras suplementações
Ácidos graxos de ômega 3 e 6
Os ácidos graxos poli-insaturados abrangem as famílias de ácidos graxos ômega-3 e ômega-6, relacionados ao desenvolvimento e funcionalidade cerebral. Recentemente, estes também foram associados a efeitos anti-inflamatórios e influenciadores no comportamento e humor.30 O metabolismo defeituoso desses ácidos e uma baixa concentração dos mesmos foram observados em crianças com TEA, o que passou a ser associado ao aumento de citocinas inflamatórias, estresse oxidativo e disfunção de neurotransmissores.30, 31 Com base nessas constatações e teorias, a suplementação com ômega-3 e ômega-6 passou a ser testada para melhora de alguns aspectos da doença.
Apesar de ainda haver muitos estudos controversos e com heterogeneidade de amostra e metodologia, os artigos analisados nesta revisão concluíram, quase por unanimidade, pela ineficácia dessa abordagem suplementar.3,19,29,30 Como ressaltado por Monteiro et al., os estudos não concordam em tempo de intervenção, dose ou características da amostra, além de, na maioria das vezes, ainda possuírem baixa amostragem.3
O único artigo da coletânea que conclui um desfecho benéfico na suplementação de ômega 3 foi o de Fraguas et al. Segundo sua metanálise, a suplementação deste ácido graxo esteve associada a melhorias na linguagem, déficits sociais e sintomas associados ao autismo. Porém, como exposto por ele, os resultados sugeriram um efeito inespecífico e pequeno na doença.32
Enzimas digestivas
A exposição do organismo ao glúten e a caseína, dentre vários resultados, gera aumento de substâncias chamadas de exorfinas (compostos semelhantes à endorfina), que são substâncias que interagem com receptores opiáceos, ativando-os no cérebro. Evidências crescentes acerca da relação cérebro-intestino sugerem que enzimas digestivas com função de proteólise podem remover essas exorfinas, contribuindo para a modulação de alguns sintomas, incluindo os de autismo.18
Sathe et al. analisaram a eficácia da suplementação à base de enzimas proteolíticas e os resultados foram inconclusivos, com um dos artigos demonstrando a ineficácia do método e outro, com suplementação de “Neo-disgestin”, expondo avanço nos escores de gravidade dos sintomas após três meses de tratamento.29
N-acetilcisteína
A N-acetilcisteína é um pró-fármaco que ajuda a manter e formar glutationa, composto com importante função antioxidante. Seu uso está em ampla investigação para diversas síndromes psiquiátricas. Mierau & Neumeyer analisaram sua eficácia no suporte do TEA e encontraram alguns resultados de melhora na irritabilidade e comportamentos repetitivos.30
Dietas especiais
Dietas sem glúten e sem caseína
A primeira análise de uma correlação entre glúten e TEA foi feito em 1969 por Goodwin & Goodwin,33 que observaram progresso comportamental em uma criança, também celíaca, de sua coorte, após uma restrição de glúten em sua dieta.11 A partir desse marco, diversos estudos passaram a ser realizados com base em teorias de um estado pró-inflamatório desencadeado pelo glúten e, posteriormente, pela caseína.13,19 Assim, tentativas terapêuticas com dietas restritas de glúten e/ou caseína passaram a ser implantadas e examinadas, sendo a base delas uma alimentação com exclusão de todos os alimentos que contenham trigo, aveia, cevada ou centeio, atreladas à não ingestão de laticínios.22
Foi demonstrado que crianças com TEA possuem altos níveis de anticorpos antigliadina (proteína específica do glúten) e anticaseína (proteína presente em produtos lácteos), além de um anticorpo contra uma enzima envolvida no processamento da gliadinomorfina-7 (um subproduto da gliadina). O excesso desta última substância cursa com alta atividade opioide, estimulando os receptores de todo o organismo, principalmente no cérebro.11
Peptídeos dietéticos também são degradados a substâncias intermediárias (conhecidas como exorfinas) que possuem atividade opioide e cursam com efeitos negativos na atenção, maturação cerebral, comunicação social e aprendizagem.8,11,14,23,34 Assim, quando os níveis desses peptídeos aumentam, as funções cerebrais são afetadas.14 Algumas pesquisas ainda estudam a capacidade de medir esses peptídeos através da urina, como prova da atividade opioide, apesar de certos autores apontarem que dietas livres de glúten e caseína diminuam os peptídeos urinários14,22 e outros não observarem diferença nesse marcador.12,14
Outra alteração importante é a diminuição do fator de necrose tumoral em pacientes com TEA e em dietas restritas de glúten e caseína, comprovando menor atividade inflamatória. No entanto, mesmo que o mecanismo dessa terapêutica tenha lógica e algumas alterações laboratoriais sejam observadas, esta revisão não encontrou dados de elevado nível científico que corroborem a indicação de uma dieta restrita em glúten e caseína.
Foram avaliadas quatro revisões sistemáticas/metanálise3,10,28,35 e sete revisões não sistemáticas,8,11,12,14,19,22,29 sendo unânime entre todas a escassez de estudos com rigor metodológico que demonstre benefícios de uma dieta de exclusão de glúten e caseína. A grande maioria dos ensaios clínicos verificados por essas revisões não observou mudanças em funções mentais, enquanto os estudos que verificaram melhora comportamental costumavam ter um período de intervenção menor que seis meses, sem fiscalização quanto à real exclusão de alimentos com glúten e caseína, além de, na maioria das vezes, as mudanças serem relatadas pelos cuidadores e não por pesquisadores (mesmo que esses tenham sido “treinados” para aplicar escalas). Além da incerteza do benefício proposto por dietas GFCF (glutenfree,caseinfree), revisões não sistemáticas sugerem que essa intervenção, na ausência de intolerância, pode acarretar efeitos colaterais no trato gastrointestinal, com aumento de patógenos oportunistas e diminuição de populações benéficas, e até mesmo outros distúrbios metabólicos, como deficiência de cálcio, vitamina D, vitamina B e aminoácidos essenciais, com consequente redução da densidade mineral óssea.22,14
Dieta cetogênica
Já utilizada como um atenuante para casos de epilepsia refratária a medicamentos, as dietas ricas em gordura e pobres em carboidratos (também conhecidas como dietas cetogênicas) mostram-se, em ensaios limitados, como uma opção eficaz para a atenuação dos sintomas de casos leves e moderados de TEA. Dentre eles, déficits comportamentais (como os relacionados à sociabilidade e a padrões repetitivos), além de gerar respostas em nível celular como na formação de mielina, matéria branca e vias de sinalização neurotransmissora, incluindo glutamato, serotonina, sintase de ácido nítrico neuronal e dopamina.22
Além de carecer de ensaios clínicos robustos, sendo limitados a estudos com camundongos e pequenos grupos populacionais, sua implementação efetiva depende de uma adesão completa à dieta, o que se mostra um desafio, tendo em vista a seletividade alimentar e o baixo nível de tolerância a alimentos apresentada pelo TEA.3,8,9 Sendo assim, a escassez de estudos voltados para o tema não é suficiente para afirmar sua efetividade como uma forma de tratamento para o TEA, por isso, essa dieta não é recomendada para tal finalidade.
Comentários finais
Esta revisão concluiu que a literatura ainda carece de estudos de maior qualidade para que condutas nutricionais sejam prescritas visando à atenuação dos sintomas comportamentais de pacientes com TEA.
Referências
1. Harris J. Leo Kanner and autism: a 75-year perspective. Int Rev Psychiatry. 2018 Feb;30(1):3-17. doi: 10.1080/09540261.2018.1455646. Epub 2018 Apr 18. PMID: 29667863.
2. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. American Psychiatric Association; Arlington, VA, USA: 2013.
3. Monteiro MA, Santos AAAD, Gomes LMM, Rito RVVF. AUTISM SPECTRUM DISORDER: A SYSTEMATIC REVIEW ABOUT NUTRITIONAL INTERVENTIONS. Rev Paul Pediatr. 2020 Mar 16;38:e2018262. doi: 10.1590/1984-0462/2020/38/2018262. PMID: 32187297; PMCID: PMC7077797.
4. Esteban-Figuerola P, Canals J, Fernández-Cao JC, Arija Val V. Differences in food consumption and nutritional intake between children with autism spectrum disorders and typically developing children: A meta-analysis. Autism. 2019 Jul;23(5):1079-1095. doi: 10.1177/1362361318794179. Epub 2018 Oct 21. Erratum in: Autism. 2020 Feb;24(2):531-536. PMID: 30345784.
5. Sharp WG, Postorino V, McCracken CE, Berry RC, Criado KK, Burrell TL, Scahill L. Dietary Intake, Nutrient Status, and Growth Parameters in Children with Autism Spectrum Disorder and Severe Food Selectivity: An Electronic Medical Record Review. J Acad Nutr Diet. 2018 Oct;118(10):1943-1950. doi: 10.1016/j.jand.2018.05.005. Epub 2018 Jul 10. PMID: 30005820.
6. Peretti S, Mariano M, Mazzocchetti C, Mazza M, Pino MC, Verrotti Di Pianella A, Valenti M. Diet: the keystone of autism spectrum disorder? Nutr Neurosci. 2019 Dec;22(12):825-839. doi: 10.1080/1028415X.2018.1464819. Epub 2018 Apr 19. PMID: 29669486.)
7. Paula CS, Fombonne E, Gadia C, Tuchman R, Rosanoff M. Autism in Brazil: perspectives from science and society. Rev Assoc Med Bras 2011; 57(1):2-5.
8. Doreswamy S, Bashir A, Guarecuco JE, et al. Effects of Diet, Nutrition, and Exercise in Children With Autism and Autism Spectrum Disorder: A Literature Review. Cureus. 2020;12(12):e12222. Published 2020 Dec 22. doi:10.7759/cureus.12222
9. Magagnin T, Silva MA, Nunes RZ, Ferraz F, Soratto J. Aspectos alimentares e nutricionais de crianças e adolescentes com transtorno do espectro autista. Physis: Revista de Saúde Coletiva [online]. 2021; v. 31, n. 01. doi:10.1590/S0103-73312021310104.
10. Keller A, Rimestad ML, Friis Rohde J, Holm Petersen B, Bruun Korfitsen C, Tarp S, Briciet Lauritsen M, Händel MN. The Effect of a Combined Gluten- and Casein-Free Diet on Children and Adolescents with Autism Spectrum Disorders: A Systematic Review and Meta-Analysis. Nutrients. 2021 Jan 30;13(2):470. doi: 10.3390/nu13020470. PMID: 33573238; PMCID: PMC7912271.
11. Croall ID, Hoggard N, Hadjivassiliou M. Gluten and Autism Spectrum Disorder. Nutrients. 2021 Feb 9;13(2):572. doi: 10.3390/nu13020572. PMID: 33572226; PMCID: PMC7915454.
12. Alamri ES. Efficacy of gluten- and casein-free diets on autism spectrum disorders in children. Saudi Med J. 2020 Oct;41(10):1041-1046. doi: 10.15537/smj.2020.10.25308. PMID: 33026043; PMCID: PMC7841518.
13. Marí-Bauset S, Llopis-González A, Zazpe I, Marí-Sanchis A, Suárez-Varela MM. Nutritional Impact of a Gluten-Free Casein-Free Diet in Children with Autism Spectrum Disorder. J Autism Dev Disord. 2016 Feb;46(2):673-84. doi: 10.1007/s10803-015-2582-7. PMID: 26428353.
14. Baspinar B, Yardimci H. Gluten-Free Casein-Free Diet for Autism Spectrum Disorders: Can It Be Effective in Solving Behavioural and Gastrointestinal Problems?. Eurasian J Med. 2020;52(3):292-297
15. Robea MA, Luca AC, Ciobica A. Relationship between Vitamin Deficiencies and Co-Occurring Symptoms in Autism Spectrum Disorder. Medicina (Kaunas). 2020 May 20;56(5):245. doi: 10.3390/medicina56050245. PMID: 32443822; PMCID: PMC7279218.
16. Saad K, Abdel-Rahman AA, Elserogy YM, Al-Atram AA, Cannell JJ, Bjørklund G, Abdel-Reheim MK, Othman HA, El-Houfey AA, Abd El-Aziz NH, Abd El-Baseer KA, Ahmed AE, Ali AM. Vitamin D status in autism spectrum disorders and the efficacy of vitamin D supplementation in autistic children. Nutr Neurosci. 2016 Oct;19(8):346-351. doi: 10.1179/1476830515Y.0000000019. Epub 2015 Apr 15. PMID: 25876214.
17. Martins BP, Bandarra NM, Figueiredo-Braga M. The role of marine omega-3 in human neurodevelopment, including Autism Spectrum Disorders and Attention-Deficit/Hyperactivity Disorder - a review. Crit Rev Food Sci Nutr. 2020;60(9):1431-1446. doi: 10.1080/10408398.2019.1573800. Epub 2019 Mar 18. PMID: 30880398
18. Saad K, Eltayeb AA, Mohamad IL, et al. A Randomized, Placebo-controlled Trial of Digestive Enzymes in Children with Autism Spectrum Disorders. Clin Psychopharmacol Neurosci. 2015;13(2):188-193. doi:10.9758/cpn.2015.13.2.188
19. Sivamaruthi BS, Suganthy N, Kesika P, Chaiyasut C. The Role of Microbiome, Dietary Supplements, and Probiotics in Autism Spectrum Disorder. Int J Environ Res Public Health. 2020 Apr 12;17(8):2647. doi: 10.3390/ijerph17082647. PMID: 32290635; PMCID: PMC7215504.
20. Abdellatif B, McVeigh C, Bendriss G, Chaari A. The Promising Role of Probiotics in Managing the Altered Gut in Autism Spectrum Disorders. Int J Mol Sci. 2020 Jun 10;21(11):4159. doi: 10.3390/ijms21114159. PMID: 32532137; PMCID: PMC7312735.
21. Berding K, Donovan SM. Microbiome and nutrition in autism spectrum disorder: current knowledge and research needs. Nutr Rev. 2016 Dec;74(12):723-736. doi: 10.1093/nutrit/nuw048. PMID: 27864534.)
22. Ristori MV, Quagliariello A, Reddel S, et al. Autism, Gastrointestinal Symptoms and Modulation of Gut Microbiota by Nutritional Interventions. Nutrients. 2019;11(11):2812. Published 2019 Nov 18. doi:10.3390/nu11112812
23. Grimaldi R, Gibson GR, Vulevic J, et al. A prebiotic intervention study in children with autism spectrum disorders (ASDs). Microbiome. 2018;6(1):133. Published 2018 Aug 2. doi:10.1186/s40168-018-0523-3
24. Bezawada N, Phang TH, Hold GL, Hansen R. Autism Spectrum Disorder and the Gut Microbiota in Children: A Systematic Review. Ann Nutr Metab. 2020;76(1):16-29. doi:10.1159/000505363
25. Ng QX, Loke W, Venkatanarayanan N, Lim DY, Soh AYS, Yeo WS. A Systematic Review of the Role of Prebiotics and Probiotics in Autism Spectrum Disorders. Medicina (Kaunas). 2019;55(5):129. Published 2019 May 10. doi:10.3390/medicina55050129
26. Kawicka Aw B., Regulska-IloHow nutritional status, diet and dietary supplements can affect autism. A review. Rocz Panstw Zakl Hig. 2013;64(1):1-12. PMID: 23789306.)
27. Munn Z, Peters MDJ, Stern C, Tufanaru C, McArthur A, Aromataris E. Systematic review or scoping review? Guidance for authors when choosing between a systematic or scoping review approach. BMC Med Res Methodol. 2018 Nov 19;18(1):143. doi: 10.1186/s12874-018-0611-x. PMID: 30453902; PMCID: PMC6245623.
28. Lázaro, Cristiane P. and Pondé, Milena P.Narratives of mothers of children with autism spectrum disorders: focus on eating behavior. Trends in Psychiatry and Psychotherapy [online]. 2017, v. 39, n. 3 [Accessed 31 July 2021], pp. 4-11. Available from: <https://doi.org/10.1590/2237-6089-2017-0004>. ISSN 2238-0019. https://doi.org/10.1590/2237-6089-2017-0004.
29. Sathe N, Andrews JC, McPheeters ML, Warren ZE. Nutritional and Dietary Interventions for Autism Spectrum Disorder: A Systematic Review. Pediatrics. 2017;139(6):e20170346. doi:10.1542/peds.2017-0346
30. Mierau SB, Neumeyer AM. Metabolic interventions in Autism Spectrum Disorder. Neurobiol Dis. 2019;132:104544. doi:10.1016/j.nbd.2019.104544
31. Kidd PM. Omega-3 DHA and EPA for cognition, behavior, and mood: clinical findings and structural-functional synergies with cell membrane phospholipids. Altern Med Rev. 2007;12(3):207-227.
32. Fraguas D, Díaz-Caneja CM, Pina-Camacho L, et al. Dietary Interventions for Autism Spectrum Disorder: A Meta-analysis. Pediatrics. 2019;144(5):e20183218. doi:10.1542/peds.2018-3218
33. Goodwin MS, Goodwin TC. In a dark mirror. Ment Hyg. 1969;53(4):550-563.
34. Adams JB, Audhya T, Geis E, et al. Comprehensive Nutritional and Dietary Intervention for Autism Spectrum Disorder-A Randomized, Controlled 12-Month Trial. Nutrients. 2018;10(3):369. Published 2018 Mar 17. doi:10.3390/nu10030369
35. Clappison E, Hadjivassiliou M, Zis P. Psychiatric Manifestations of Coeliac Disease, a Systematic Review and Meta-Analysis. Nutrients. 2020;12(1):142. Published 2020 Jan 4. doi:10.3390/nu12010142