Número atual: 9(2) - Novembro 2008
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Revisoes em Pediatria
Febre reumática - ainda um desafio
Rheumatic fever - still a challenge
Katia Lino Baptista Mourilhe Rocha1; Rodrigo Moulin Silva2
1. Especialista em Reumatologia Infantil pela SBP e pela SBReumatologia Pediátrica/AMB. Especialista em Pediatria pela SBPediatria/AMB (Coordenadora do Serviço de Reumatologia Infantil do Hospital Universitário Antônio Pedro / Universidade Federal Fluminense. Presidente do GT de Febre Reumática - SOPERJ)
2. Especialista em Pediatria pela SBPediatria/AMB (Especializando de 2º ano em Reumatologia Pediátrica no Instituto de Pediatria e Puericultura Martagao Gesteira / UFRJ )
Endereço para correspondência:
Universidade Federal Fluminense
Av. 28 de setembro, 389 - sala 604 - Vila Isabel
Rio de Janeiro/RJ - CEP 20551-030.
email: katialino@openlink.com.br
Nao houve nenhum suporte financeiro.
Resumo
INTRODUÇÃO: A febre reumática continua sendo de alta prevalência em países em desenvolvimento e é responsável por alto impacto sócio-econômico, sendo a principal causa de cardiopatia adquirida na infância. Ainda hoje, existem diversas controvérsias em seu diagnóstico e manejo.
OBJETIVO: Rever o papel dos critérios de T. Duckett-Jones, identificar falhas nas políticas públicas e tentar unificar condutas terapêuticas e de profilaxia.
MÉTODOS E FONTES DOS DADOS: Revisão não sistemática da literatura nacional e internacional, através de busca pelo PubMed, referente aos ao período de 1965 a 2007. Literatura disponível no MEDLINE e acessível pelo portal da CAPES. Foram listados mais de 300 artigos, sendo selecionadas 46 referências para esta revisão, incluindo livros-texto reconhecidamente importantes.
SÍNTESE DOS DADOS: A febre reumática ainda necessita de políticas de saúde mais agressivas, com treinamento de pessoal e fornecimento de medicações básicas, além de ações educacionais. São necessárias implementações de medidas para melhorar a adesão ao regime terapêutico e maior acesso a métodos laboratoriais e de imagem (ecocardiograma). Atualmente, surge nova esperança no combate à doença com o desenvolvimento inicial de vacinas anti-estreptocócicas.
Palavras-chave: Febre Reumática, Cardiopatia Reumática, Estreptococo, Penicilina Benzatina, Coréia.
Abstract
INTRODUCTION: Rheumatic fever still has high prevalence in developing countries, and is responsible for high socioeconomic impact, being the primary cause of acquired cardiopathy in children. There are many controversies in its diagnosis and management.
OBJECTIVES: To review the role of T. Duckett Jones criteria, identify public policies failure, and try to unificate therapeutic and prophilatic measures.
METHODS: Non-systematic review of national and international literature, through PubMed, in the period from 1965 to 2007. Available literature in MEDLINE, and accessible via CAPES portal. Over 300 articles were enrolled, and 46 references were selected, including recognized textbooks.
CONCLUSIONS: More aggressive public health policies against rheumatic fever are needed, which must include health professionals training, providing basic medications and educational measures. Implementation of measures directed toward adhesion of prophylactic regimens, and providing better access to laboratory tests and echocardiogram are necessary. Nowadays, a new hope is elicited with the initial development of vaccines against streptococcus.
Keywords: Rheumatic Fever, Rheumatic Heart Disease, Streptococcus, Benzathine Penicillin G, Chorea.
INTRODUÇÃO
A febre reumática (FR) resulta de uma resposta auto-imune à infecção pelo estreptococo b-hemolítico do grupo A (EBHGA) de Lancefield. Caracteriza-se por uma complicação tardia, não-supurativa, de uma infecção estreptocócica, que ocorre em pessoas geneticamente predispostas1-3.
A FR e sua seqüela crônica, a cardiopatia reumática (CR), são responsáveis por importante morbi-mortalidade em crianças e adultos jovens, e alto impacto socio-econômico. Apesar da redução do número de casos em países desenvolvidos, continua sendo de alta prevalência em países em desenvolvimento1-5, sendo a doença reumatológica mais comum em crianças no Brasil, constituindo a principal causa de cardiopatia adquirida na infância e, também, a mais passível de prevenção2.
Estudo realizado em São Paulo, em 2000, estimou os custos do tratamento da FR foram de R$ 367 no sistema público; R$ 487, nos planos de saúde; e R$ 787, para pacientes particulares. Os custos estimados para a profilaxia secundária com Penicilina Benzatina de 21/21 dias foram de R$ 26,50 por paciente. Custos anuais, considerando tratamento para todos os pacientes diagnosticados no país, foram de R$ 58.816.000. Os custos indiretos foram baseados em absenteísmo ao trabalho e escolar, levando a repetência de algumas crianças, e deduções salariais ou demissão para seus pais6, portanto a realização da profilaxia é muito mais barata do que tratar as conseqüências da doença.
Ainda hoje, existem diversas controvérsias sobre o assunto, como o papel efetivo dos critérios de Jones para diagnóstico7-10; a utilidade do ecocardiograma (ECO) como critério isoladamente3,11-16; o manejo terapêutico mais adequado das manifestações clínicas3,17,18-29; qual o melhor regime profilático e formas de melhorar a adesão terapêutica1-3,5,17,30,31; e a tentativa de desenvolver vacinas contra o estreptococo do grupo A1-3,5,32,33-35.
Etiologia
FR desenvolve-se, em média, após 1 a 3 semanas da infecção estreptocócica. A proteína M, localizada na camada externa da parede celular desse coco Gram-positivo, possui alta capacidade antigênica e virulência1-3,5,32,36. A hipótese mais aceita para o desenvolvimento da doença é o mimetismo molecular entre estruturas antigênicas do estreptococo e antígenos do hospedeiro. Sabe-se que há grande semelhança entre regiões da proteína M e estruturas como miosina, laminina e núcleos da base, por exemplo1-3,5,37. O EBHGA produz diversas enzimas (estreptolisinas O e S, hialuronidase, estreptoquinase, desoxirribonuclease B) que contribuem para sua virulência1-3,32,37.Apesar da suposição de que a FR é causada por infecção de orofaringe pelo EBHGA, trabalhos recentes postulam que outros grupos (C, G) poderiam estar envolvidos na patogênese da doença, demonstrando sua reatividade à miosina e capacidade de aderência e invasão. Entre os aborígines australianos, população de alta incidência de FR, há baixa incidência de faringite por estreptococo do grupo A, sendo isolados patógenos dos grupos C e G (que podem ter adquirido potencial reumatogênico por transmissão horizontal de material genético com o grupo A) em alguns pacientes. Existe também a possibilidade do estreptococo ser advindo de lesão cutânea5,38-39. Outros tipos de proteína M têm sido descritos como causadores de FR40.
Predisposição genética é necessária, havendo associação com o HLA-DR4, DR-2, D7 em nosso meio, e uma possível associação com o anticorpo D8/17, dirigido contra antígenos das células B1-2,5,36.
Epidemiologia
Estimativas da Organização Mundial da Saúde (OMS) indicam a existência de 18,6 milhões de pessoas no mundo com CR, 282.000 novos casos/ano e 233.000 mortes por ano4,5,41. Estudos feitos na América Latina indicam incidência de 19,6 casos/100.000 e 21.222 novos casos/ano4. Um trabalho de Belo Horizonte - Brasil, mostrou incidência de 360 casos/100.000/ano, com pacientes entre 10 e 20 anos4,42.
Esses dados são subestimados, tendo em vista o grande número de casos não relatados, resultante de alguns fatores: a maioria deles advém de dados de internação hospitalar, sendo que grande parte dos casos consiste em pacientes exclusivamente ambulatoriais; FR não é doença de notificação compulsória; dificuldade de acesso a cuidados de saúde por parcela importante da população; atendimento pulverizado aos pacientes, vistos por pediatras/clínicos, cardiologistas ou reumatologistas, dificultando a unificação dos dados, e por esta razão a maioria dos dados disponíveis são de CR e não de FR.
Ocorre mais comumente dos 5 aos 15 anos de idade, sendo rara abaixo dessa idade (menos de 5%), e virtualmente inexistente antes dos 2 anos1-3,43.
Critérios de jones
Estabelecidos em 1944, já sofreram modificações, revisões e atualizações7,8,9, que aumentaram a especificidade, diminuindo a sensibilidade5. A última atualização data de 2002-03, feita pela OMS3. Apesar dos esforços para melhorá-los, ainda não se conseguiu um consenso. Cumpre lembrar que se trata de critério diagnóstico e, como tal, deve ser adaptado em situações de grande suspeição clínica, particularmente em locais de alta prevalência e risco para FR, onde a interpretação estrita dos critérios pode levar ao subdiagnóstico10,44. Estes se encontram listados na Tabela 1, comparando-os aos originais descritos por Jones.

Para o diagnóstico de 1º surto, são necessários: dois critérios maiores, ou 1 critério maior e dois menores; mais evidência de infecção estreptocócica recente, como consideração especial1-3,5.
Os critérios de 2002-03 da OMS estabelecem, para diagnóstico de novo surto, que3:
1. Para pacientes com CR prévia: são necessários apenas dois critérios menores mais evidência de infecção estreptocócica.
2. Para pacientes com coréia ou cardite insidiosa (excluindo endocardite): não são necessários outros critérios maiores, nem evidência de estreptococcia.
3. Para pacientes com lesões valvares crônicas de CR (pacientes apresentando-se, pela primeira vez, com estenose mitral pura, ou dupla lesão mitral e/ou lesão aórtica): não são necessários outros critérios para diagnóstico de CR.
Artrite - Presente em 75% dos casos. Considera-se para critério poliartrite, tipicamente migratória, acometendo grandes articulações (joelhos, cotovelos, punhos, tornozelos), auto-limitada (em torno de 3-4 semanas), dor desproporcional aos achados de exame físico, com ótima resposta a antiinflamatórios não-hormonais (AINES)1-3,27. Entretanto, há relatos de manifestações atípicas, com tempo de latência variável e duração da artrite por tempo prolongado (meses a anos), podendo acometer colunas cervical e lombar, articulações sacroilíacas, ênteses e pequenas articulações de mãos e pés1,2,5,10,44,45. Pode ocorrer monoartrite. A artrite da FR não costuma deixar seqüelas1,2,17. É necessário diferenciar da Artrite Reativa Pós-Estreptocócica (ARePE), cujo primeiro relato data de 1982, e que apresenta menor tempo de latência (geralmente, menor que dez dias). Apresenta padrão de poliartrite aditiva e simétrica, muito dolorosa e com resposta parcial a AINES. Acomete pequenas articulações das mãos, e evolui com maior tempo de duração da artrite (10 a 20 semanas). Existem casos relatados de associação da ARePE com desenvolvimento de cardite, estando indicada a profilaxia contra estreptococo para esses pacientes2,5.
Cardite - Presente em 50% dos pacientes1,37. É a principal manifestação clínica, sendo a maior responsável pela morbi-mortalidade. Pode acometer qualquer parte do coração. Taquicardia, desproporcional à febre, bradicardia, extra-sístoles, sopros, aumento da área cardíaca, hipofonese de bulhas, ritmo de galope e insuficiência cardíaca. Acometimentos mitral e aórtico são os mais freqüentes, seguidos por tricúspide e pulmonar (raro)1-3.
Sopro sistólico apical (podendo ser irradiado para axila e dorso), holossistólico, de insuficiência mitral (com ou sem sopro de Carey-Coombs - mesodiastólico de ponta, transitório, suave) é o mais freqüente, podendo estar acompanhado de sopro proto-diastólico de insuficiência aórtica. Em indivíduos com CR prévia, mudança na característica do sopro ou aparecimento de novo sopro indicam cardite1-3.
Insuficiência cardíaca (IC) e cardiomegalia são manifestações de miocardite, decorrentes de grave incompetência valvar3.
Também pode haver atrito pericárdico, derrame, dor precordial e hipofonese de bulhas, manifestações de pericardite. O eletrocardiograma (ECG) mostra complexo QRS de baixa voltagem e alterações em ST-T2-3.
Coréia de Sydenham - Presente em 5 a 36% dos casos. Principalmente em crianças, ocorrendo mais em meninas, na adolescência. Acomete neoestriado, putâmen e núcleo caudado. Pode ser uni ou bilateral. Possui tempo de latência longo, aparecendo até seis meses após a infecção estreptocócica. Caracterizada por labilidade emocional (alterna choro e riso, agressividade), movimentos incoordenados e involuntários, abruptos e erráticos de grupos musculares esqueléticos. Fraqueza muscular, irritabilidade, desatenção, tendência a deixar cair objetos. Movimentos faciais e reptiliformes da língua, além de alterações na fala e na escrita. Dificuldade na marcha, com tropeços à deambulação. Pode haver hipotonia generalizada (coréia mole). Apresentam o "sinal da ordenha" e o "sinal do pronador". Desaparecem durante o sono1-3,17,21. Pacientes com coréia inicial devem ser avaliados com ECO para detectar cardite, que pode estar presente em até 70% dos casos22.
Nódulos subcutâneos - Raros (5%), quase sempre associados a cardite. São pequenos, indolores e móveis, encontrando-se, preferencialmente, em superfícies extensoras, relevos ósseos, ou locais de inserção tendínea. Duram de semanas a meses1-3.
Eritema marginado - Encontrado em até 10% dos casos. Consiste em máculas ou pápulas róseas ou vermelho-claras, com bordos bem delimitados, de aspecto serpiginoso. Não pruriginosos e indolores. Vistos em abdome, tórax e dorso, poupando face1-3,17. Podem ser elicitados por banho morno. São evanescentes e também estão associados à cardite. Podem recorrer por meses ou anos1-3.
Poliartralgia - Inicialmente, considerada como critério maior, porém possui pouca especificidade. É comum em FR, costumando envolver grandes articulações1,3.
Febre - Presente na maioria dos casos de 1º surto, variando de 38,4 a 40ºC, não havendo padrão característico1,3,5.
Elevação de provas de atividade inflamatória - Leucocitose, Velocidade de Hemossedimentação (VHS) e Proteína C-Reativa (PCR)1-3.
Alargamento do intervalo P-R do ECG - Maior que 0,2 segundos1.
Evidência de infecção estreptocócica - Não existe nenhum teste disponível para o diagnóstico definitivo de FR. Em nosso meio, o mais utilizado para confirmar a infecção pelo EBHGA é a antiestreptolisina O (ASO, o mais freqüente e mais simples de ser dosado). Sua elevação não se traduz em FR, apenas indica estreptococcia. Em crianças, é normal encontrar esses valores elevados, tanto maiores quanto mais idade tiver a criança2.
Seus títulos elevam-se a partir da segunda semana da infecção, com nível máximo entre a 3ª e a 5ª semanas. Deve-se repetir a dosagem com intervalo mínimo de 15 dias, e uma elevação de 4 vezes no título inicial confirma a infecção. Outro fator de confusão reside no fato dos títulos poderem permanecer elevados por até 12 meses, sem relação com reinfecção. A aplicação de Penicilina Benzatina (BZT) mais freqüente não provoca redução dos níveis da ASO, não estando indicada2.
Swab de orofaringe - Pouca positividade (em torno de 40 a 50%), pois é comum que seja colhido tardiamente ou após início de antibioticoterapia. A cultura de orofaringe constitui o padrão ouro para diagnóstico. Os testes rápidos para detecção direta de antígenos, que fornecem o resultado em poucos minutos1-2, anti-hialuronidase, e antidesoxirribonuclease B, também não se encontram disponíveis em serviços públicos, devido ao alto custo.
Escarlatina - Diagnóstico de escarlatina recente (menos de 45 dias) voltou a ser considerado como evidência de estreptococcia pela atualização de 2002-03 da OMS3.
Laboratório
Não é definitivo, mas dá suporte ao diagnóstico. Conta como um critério menor. Os exames indicados são: Hemograma - Não costuma se alterar muito, podendo haver leucocitose com neutrofilia (não muito pronunciadas). Pode haver anemia2.
Velocidade de Hemossedimentação (VHS) - O melhor método para a VHS é o de Westerngreen, que usa pipetas de 200 mm. Só levamos em consideração o resultado da 1ª hora, já que o da 2ª hora não se mostrou confiável. Considera-se normal até 20 mm. Sempre elevado no surto agudo, podendo chegar a valores acima de 100 mm na 1ª hora. Sofre influência de diversas condições (anemia, gravidez, acidose) e não serve para acompanhamento de atividade, diminuindo com início da terapêutica1-2.
Proteína C-Reativa (PCR) - Precipitação do polissacarídeo C da cápsula do pneumococo. Positiva até 2ª semana do quadro agudo. Meia-vida em torno de 6 horas. Também influenciada pela terapêutica2.
Outros exames solicitados que demonstram atividade inflamatória, sem serem considerados nos critérios, incluem: Mucoproteínas (a-1 glicoproteína ácida) - Migram na fração a-2 globulinas da eletroforese de proteínas. Não influenciadas pela terapêutica, costumam oscilar com a evolução clínica, adquirindo importância no seguimento da doença2.
Eletroforese de proteínas - Elevação de a-2 e a-1 globulinas pode ser encontrada, além de elevação de gamaglobulinas e redução de albumina2.
Avaliação cardíaca Radiografia de Tórax - Pode mostrar aumento de área cardíaca, alargamento de mediastino. Nesses casos, fazer com esôfago contrastado, para detectar rechaçamento esofágico1,2.
ECG - Analisar presença de distúrbios de condução, sinais de miocardite e pericardite, como bloqueio atrioventricular de 1º grau ou aumento do intervalo P-R (normal até 0,2 segundos)1,2.
Outros métodos têm sido estudados: Ressonância Nuclear Magnética, Tomografia Computadorizada de Alta Resolução, Cintilografia, ainda de difícil obtenção e caros, não sendo usados rotineiramente2,3.
Ecocardiograma (ECO)
Elemento-chave para o diagnóstico de CR. Pode ser transtorácico (TT), transesofágico (TE) ou intracardíaco. Para diagnóstico de CR e avaliação de lesão valvular, torna-se suficiente a realização da ecodopplercardiografia bidimensional transtorácica (já desenvolvidos o tridimensional - 3D e quadridimensional - 4D). Podemos avaliar função ventricular e estruturas anatômicas3.
Importante para diferenciar lesões reumáticas de sopros inocentes e cardiopatias congênitas. Provê diagnóstico diferencial com endocardite3,16.
Apesar de não ser solicitado em todos os casos suspeitos de FR, estudos recentes advogam a necessidade de se realizar ECO sempre, tendo em vista a capacidade de detectar regurgitações e lesões em pacientes com ausculta e ECG normais11-14,16.
Informa tamanho de câmeras cardíacas, espessamento valvar, prolapso de folheto, falha de coaptação, restrição de mobilidade e disfunção ventricular. IC parece estar associada a lesão valvar grave, ao invés de disfunção miocárdica. Ruptura de cordoalha constitui emergência cirúrgica. Visualização direta dos fluxos sanguíneos e detecção de derrame pericárdico3.
O ECO serve também para diagnóstico de cardite insidiosa, detectando insuficiência mitral (IM) ou aórtica (IA), excluindo causas congênitas ou adquiridas (endocardite, doenças sistêmicas). Nesses casos, é recomendado considerar tais casos como CR até prova em contrário e iniciar profilaxia secundária12,13,16.
No diagnóstico de novo surto em paciente com CR prévia, este geralmente associa-se a cardite, manifesta como: pericardite, nova lesão valvar ou agravamento de lesão prévia, IC3.
Em alguns casos, o ECO pode detectar significativa regurgitação mitral e/ou aórtica, silenciosas, em pacientes com FR aguda. Chamada de "cardite/valvulite subclínica" ou "ecocardite". Nesses casos, pode haver dilatação anular, prolapso de folheto ou alongamento de cordoalha6,11,14,16. Esses pacientes podem desenvolver sopro ou, até mesmo, evoluir para seqüelas irreversíveis.
Existe grande preocupação atual, no que concerne à utilidade do ECO para diagnóstico de cardite e como critério maior. Apesar da "cardite subclínica" não ser considerada como critério pela OMS em sua revisão, nos últimos anos, diversos estudos têm sido publicados mostrando a importância do ECO nessa situação e sugerindo sua inclusão como critério6,12-16.
Diagnóstico diferencial
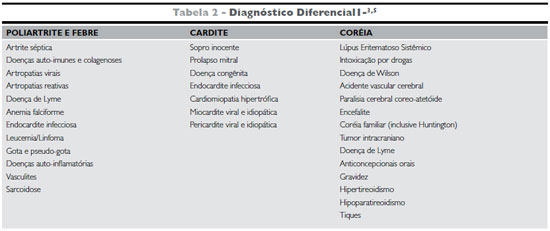
Diversas doenças devem ser consideradas, estando listadas na tabela 2.
Tratamento
Medidas Gerais - Estas incluem repouso relativo (para pacientes com artrite), ou no leito por, pelo menos, quatro semanas (pacientes com cardite). Este manejo é individualizado e varia de acordo com a clínica. Pacientes com coréia importante podem ser colocados em ambiente protegido, com a finalidade de impedir que se machuquem1-3.
Artrite - O tratamento mais usado é com ácido acetil-salicílico (AAS) 80-100 mg/Kg/dia, dividido em 4 tomadas diárias (dose máxima em crianças: 3 gramas/dia)1-3. Estão indicados protetores gástricos, como ranitidina e omeprazol, visando diminuir o risco de gastrite e aumentar a adesão. Como alternativa ao AAS, encontramos o naproxeno, na dose de 10-20 mg/Kg/dia, dividido em duas tomadas, principalmente em pacientes que não podem usar o AAS3. Estudos recentes sugerem eficácia semelhante, com perfil de segurança adequado18,19. Ainda faltam estudos maiores e randomizados corroborando essa informação. Outra opção seria o ibuprofeno 30-40 mg/Kg/dia17.
De suma importância é não iniciar nenhum tipo de AINE antes da confirmação diagnóstica, sob pena de mascarar sinais e sintomas, alterar evolução clínica e exames laboratoriais, dificultando, desta forma, o diagnóstico3.
Cardite - A abordagem mais indicada atualmente consiste em corticoterapia com prednisona 2 mg/Kg/dia (máximo: 60 mg/dia), por 2-3 semanas e redução gradual posterior (6-12 semanas)1-3,17, não havendo necessidade de associar AINES2,17. Existe relato de uso de pulsoterapia com metilprednisolona (30 mg/Kg/dia. Máximo de 1 grama/dia), em pacientes com cardite grave20, porém mais estudos são necessários. Estudo feito com Imunoglobulina humana intravenosa não mostrou diferença na evolução da CR29.
IC - O manejo da IC é feito com repouso, dieta adequada, diuréticos, digitálicos, inotrópicos, inibidores da enzima conversora de angiotensina e oxigênio, se houver hipóxia2-3.
Coréia - Deve-se prover ambiente calmo para o paciente, evitando estímulos luminosos e estresse. Apesar da noção inicial de que a maioria dos casos é leve e não necessita intervenção farmacológica, um curso arrastado (pode durar 2-3 anos) pode levar a incapacidades e isolamento social1-3.
Vários medicamentos já foram utilizados na coréia, sendo os mais comuns, em nosso meio, o haloperidol e o ácido valpróico2.
O haloperidol é usado em doses que variam de 0,5 a 6 mg/dia. O maior problema desse medicamento é a impregnação, que não depende da dose e sim da sensibilidade individual, levando ao parkinsonismo2,17. Uma estratégia para evitar esse efeito colateral é o uso associado da prometazina2.
O ácido valpróico, na dose de 20-40 mg/dia, em 3 ou 4 tomadas também tem boa eficácia, com menor incidência de efeitos colaterais (cefaléia, hepatite, plaquetopenia)2,17,21,23. Trabalhos indicam superioridade do ácido valpróico em comparação com haloperidol e carbamazepina24.
Carbamazepina21 na dose de 4-10 mg/Kg/dia, em 2 tomadas, provou ser eficaz em um estudo prospectivo de Israel25; e em outro estudo turco, na dose de 15 mg/Kg/dia, que não mostrou diferença entre carbamazepina e ácido valpróico26. Não é uma medicação usada rotineiramente para esse fim, entretanto.
Corticosteróides, apesar de não recomendados ainda pela OMS, já encontram embasamento em diversos trabalhos mostrando excelente resposta da coréia. Tem-se utilizado a prednisona na dose de 2 mg/Kg/dia, isoladamente27,28 ou em associação com ácido valpróico2.
Profilaxia
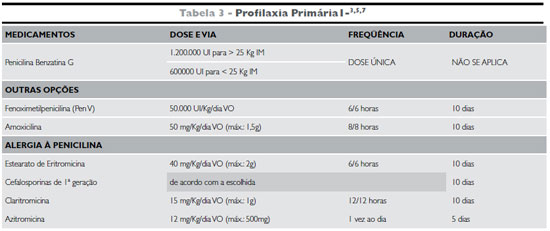
Profilaxia Primária - Consiste na terapêutica adequada das infecções de vias aéreas superiores pelo estreptococo, para prevenção da FR. Deve ser iniciada até o 9º dia da doença2,3,5. O maior problema reside no fato de até dois terços dos pacientes não terem história de dor de garganta, não procurando, portanto, assistência médica5.
A amigdalite estreptocócica afeta predominantemente crianças entre 5 e 15 anos. O tratamento mais indicado consiste na aplicação de uma dose de penicilina benzatina (1.200.000UI se paciente tiver mais de 25 Kg; 600.000 UI, em pacientes < 25 Kg). Em pacientes alérgicos a penicilina, utilizar a eritromicina. Não utilizar tetraciclinas ou sulfa, pois não erradicam o estreptococo1-3,5,17.
Cumpre ressaltar que o tratamento oral com amoxicilina ou penicilina deve ser feito por 10 dias para erradicação do estreptococo2,3,5,17. Cursos terapêuticos menores ainda não são recomendados.
Os esquemas propostos encontram-se na tabela 3.
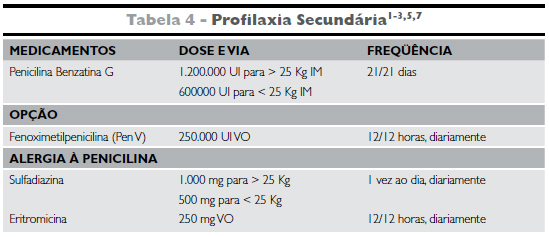
Profilaxia Secundária - O tratamento inicial da FR demanda a erradicação do EBHGA que iniciou o processo, prevenindo a perpetuação do estímulo imunológico, mesmo que o swab de orofaringe seja negativo1-3.
É realizada com administração periódica de antibióticos, preferencialmente a BZT intramuscular, a ser feita com intervalo de 21/21 dias, para pacientes com FR ou CR2,3,5,17,30. Objetiva-se a prevenção de re-colonização ou re-infecção da orofaringe desses pacientes. Atinge concentração sérica em 12-24 horas e deve ser aplicada no quadrante súpero-lateral do glúteo2,3.
Um fator que pode melhorar a adesão ao esquema e reduzir a dor associada à injeção é o acréscimo de lidocaína a 1%, sem vasoconstritor, na havendo interferência na eficácia da BZT31.
As incidências de reações alérgicas e anafiláticas por BZT são, respectivamente, 3,2% e 0,2%. Em caso de reação de hipersenssibilidade, usar anti-histamínicos ou adrenalina, dependendo da gravidade. As reações mais comuns consistem em "rash" cutâneo. Pacientes com CR grave são mais suscetíveis a manobras vaso-vagais, que podem ser confundidas com reação alérgica2-3. O teste de alergia à penicilina não se encontra indicado, pois pode ocorrer reação alérgica independente do resultado do teste pela exposição a um substrato inadequado.
Esquemas orais também podem ser realizados1-3,5,17,.entretanto, torna-se mais difícil assegurar a correta utilização. Pode haver baixa aderência por recusa em tomar remédio todos os dias, esquecimento, ou até mesmo, interferência de outras condições, como diarréia, diminuindo a absorção intestinal do medicamento2,3.
Pacientes alérgicos a penicilina, podem usar sulfadiazina (as sulfas podem ser usadas para a profilaxia secundária, pois são eficazes na prevenção da colonização. Não devem ser usadas durante a gravidez); e pacientes alérgicos também a sulfa, podem usar a eritromicina2,3,5,17 (ver Tabela 4).
Duração da profilaxia secundária
De acordo com orientações da Associação Médica Brasileira e Sociedades Brasileiras de Pediatria, Reumatologia e Cardiologia, a profilaxia deve ter as seguintes durações17:
1. Pacientes com artrite ou coréia pura: até os 18 anos de idade, ou até 5 anos após o último episódio, em caso de recidivas. A opção que durar mais.
2. Pacientes que apresentaram cardite com remissão total após o tratamento, representada pela ausência de sopros e normalidade do ECO: até 25 a 30 de idade, ou após 10 anos do último episódio (o que durar mais).
3. Pacientes com cardite residual: até os 40 anos de idade, ou até 10 anos do último episódio. O que durar mais.
4. Pacientes que foram submetidos a cirurgia de troca valvar: manter por toda a vida.
Profilaxia da Endocardite46
A profilaxia para Endocardite Infecciosa (EI) encontra-se recomendada, atualmente, para uma grande minoria dos casos. A última diretriz, publicada pela American Heart Association em 2007, limita as recomendações apenas a pacientes portadores de próteses valvares, algumas doenças cardíacas congênitas, e transplantados que desenvolvem valvulopatia, além de pacientes que já tiveram um episódio de EI.
Deve ser realizada antes de procedimentos dentários que envolvam manipulação de tecido gengival ou região periapical dos dentes, e perfuração da mucosa oral. A medicação de escolha é a Amoxicilina, na dose de 50 mg/Kg (máximo de 2 gramas), em dose única, 30 a 60 minutos antes do procedimento. As opções incluem: Ampicilina (50 mg/Kg, via IM ou IV - máximo: 2 gramas) OU Cefazolina/Ceftriaxona (50 mg/Kg, via IM ou IV - máximo: 1 grama); para pacientes alérgicos a penicilina: Cefalexina (50 mg/Kg - máximo: 2 gramas) OU Azitromicina/Claritromicina (15 mg/Kg - máximo: 500 mg) OU Clindamicina (20 mg/Kg - máximo: 600 mg, vias VO, IM ou IV) OU Cefazolina/Ceftriaxona (50 mg/Kg, via IM ou IV - máximo: 1 grama).
Também é recomendada profilaxia para procedimentos invasivos de trato respiratório, como adenoamigdalectomia e broncoscopia com biópsia, e procedimentos em pele infectada, estruturas cutâneas e tecido musculoesquelético (cobertura para Staphylococcus aureus e estreptococos b-hemolíticos).
Não é mais recomendada profilaxia para procedimentos genitourinários e gastrointestinais.
Desenvolvimento de vacinas anti-estreptocócicas
Tentativas de desenvolver uma vacina anti-estreptocócica datam do início do século passado. Atualmente, os esforços têm-se concentrado no reconhecimento da virulência da proteína M, e as vacinas em desenvolvimento são direcionadas à produção de anticorpos contra ela2-3,32-35.
Existem dificuldades, relacionadas à ampla gama de sorotipos diferentes, e à reação cruzada entre proteína M e tecidos humanos. Estudo com uma vacina 26-valente em ratos mostrou-se eficaz, sem induzir reação cruzada33. Outro trabalho com vacina 26-valente em voluntários adultos também mostrou boa imunogenicidade, com reações adversas leves e infreqüentes, sugerindo ser aceitável, apesar do baixo número de pessoas (n=30)34. Estudo de fase I com vacina hexavalente também demonstrou excelente imunogenicidade, sem reação cruzada35.
Deve-se aguardar a evolução desses estudos iniciais e o desenvolvimento de novos, mais abrangentes, para garantir a segurança e eficácia das vacinas em desenvolvimento.
Prognóstico
Maior morbi-mortalidade está associada ao grau de lesão cardíaca, com prognóstico variável1-3.
Crianças só com acometimento articular evoluem com prognóstico excelente1-2.
CONCLUSÕES
Apesar de ser uma das poucas doenças reumatológicas com agente etiológico definido e ser conhecida há décadas, ainda há dificuldades para o diagnóstico precoce e adequado, e para o acompanhamento dos pacientes portadores de FR, como: falta de recursos laboratoriais, falta de pessoal treinado, baixo nível sócio-econômico da população, demanda reprimida aos serviços públicos de saúde, ausência de políticas públicas de saúde e ações educacionais, fornecimento adequado de medicamentos e sistemas informatizados integrados pelo Sistema Único de Saúde.
Deve-se tentar uma abordagem atual dos critérios de Jones, visando maior acurácia diagnóstica, revendo a importância do papel do ECO em revelar cardite subclínica, aumentando a sensibilidade em áreas de maior prevalência.
O maior desafio ainda diz respeito à manutenção da correta profilaxia, sendo a 1ª escolha a terapêutica com Penicilina Benzatina. Medidas simples como fornecimento adequado da medicação, aplicação em postos de saúde, adição de lidocaína a 1% e compressa morna local ajudam a aumentar a adesão ao regime terapêutico.
Por fim, a pesquisa de vacinas anti-estreptocócicas apresenta-se como um horizonte promissor na redução da prevalência dessa importante doença. Entretanto, isso não será possível antes da próxima década.
Começou a ser elaborado esse ano um documento conjunto entre a Sociedade Brasileira de Pediatria, a Sociedade Brasileira de Reumatologia e a Sociedade Brasileira de Cardiologia, que promoverá uma atualização das Diretrizes para a Febre Reumática, com algumas mudanças sendo esperadas para o ano que vem.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Cassidy JT, Petty RE. Textbook of pediatric rheumatology. 5ª ed. Philadelphia, Elsevier, 2005:614-629.
2. Oliveira SKF, Azevedo ECL. Reumatologia Pediátrica, 2ª ed., Rio de Janeiro, Editora Revinter, 2001:365-400.
3. WHO. Rheumatic fever and rheumatic heart disease: reporto f a WHO Expert Consultation. Geneva, 29 October-1 November 2001. Geneva: World Health Organization, 2004.
4. Carapetis JR. The current evidence for the burden of group A streptococcal diseases. WHO/FCH/CAH/05.07. Geneva: World Health Organization, 2005.
5. Carapetis JR, McDonald M, Wilson NJ. Acute rheumatic fever. Lancet 2005;366:155-68.
6. Terreri MT et al. Resource utilization and cost of rheumatic fever. J Rheumatol 2001;28:1394-7.
7. Stollerman GH, Markowitz M, Taranta A, Wannamaker LW, Whittemore R. Committee report: Jones criteria (revised) for guidance in the diagnosis of rheumatic fever. Circulation 1965;32:664-68.
8. Committee on rheumatic fever and bacterial endocarditis of the American Heart Association. Jones criteria (revised) for guidance in the diagnosis of rheumatic fever. Circulation 1984;69:203A-208A.
9. Dajani AS et al. Guidelines for the diagnosis of rheumatic fever: Jones criteria, updated 1992. Circulation 1993;87:302-307.
10. Pereira BAF et al. Jones criteria and under diagnosis of rheumatic fever. Indian J Pediatr 2007;74(2):117-121.
11. Caldas AM et al. The case for utilizing more strict quantitative Doppler echocardiographic criterions for diagnosis of subclinical rheumatic carditis. Cardiol Young 2007;17:42-47.
12. Lanna CCD et al. Subclinical rheumatic val vitis: a long term follow-up. Cardiol Young 2003;13:431-38.
13. Özkutlu S, Ayabakan C, Saraçlar M. Can subclinical valvitis detected by echocardiography be accepted as evidence of carditis in the diagnosis of acute rheumatic fever? Cardiol Young 2001;11:255-260.
14. Narula J, Kaplan EL. Echocardiographic diagnosis of rheumatic fever. Lancet 2001;358:2000.
15. Narula J, Rahimtoola C, Rahimtoola S. Diagnosis of active rheumatic carditis: the echoes of change. Circulation 1999;100:1576-1581.
16. Marijon E et al. Prevalence of rheumatic heart disease detected by echocardiographic screening. N Engl J Med 2007;357:470-6.
17. Pereira BAF. Projeto Diretrizes. Febre Reumática. 24 de julho de 2002.
18. Uziel Y et al. The use of naproxen in the treatment of children with rheumatic fever. J Pediatr 2000;137:269-71.
19. Hashkes PJ et al. Naproxen as an alternative to aspirin for the treatment of arthritis of rheumatic fever: a randomized trial. J Pediatr 2003;143:399-401.
20. Herdy GVH et al. Rheumatic carditis treated with high doses of pulsetherapy methylprednisolone. Results in 70 children over 12 years. Arq Bras Cardiol 1999;72(5):604-606.
21. Cardoso F et al. Seminar on choreas. Lancet Neurol 2006;5:589-602.
22. Kihç A et al. Neurologic and cardiac findings in children with Sydenham chorea. Ped Neurol 2007;36(3):159-164.
23. Alvarez LA, Novak G. Valproic acid in the treatment of Sydenham chorea. Pediatr Neurol 1985;1(5):317-319.
24. Peña J et al. Comparison of the efficacy of carbamazepine, haloperidol and valproic acid in the treatment of children with Sydenham's chorea. Arq Neuropsiquiatr 2002;60(2-B):374-77.
25. Harel L et al. Successful treatment of rheumatic chorea with carbamazepine. Pediatr Neurol 2000;23:147-151.
26. Genel F, Arslanoglu S, Uran N, Saylan B. Sydenham's chorea: clinical findings and comparison of the efficacies of sodium valproate and carbamazepine regimens. Brain Dev 2002;24:73-76.
27. Barash J, Margalith D, Matitiau A. Corticosteroid treatment in patients with Sydenham's chorea. Pediatr Neurol 2005;32:205-207.
28. Paz JA, Silva CAA, Marques-Dias MJ. Randomized double-blind study with prednisone in Sydenham's chorea. Pediatr Neurol 2006;34:264-69.
29. Voss LM et al. Intravenous immunoglobulin in acute rheumatic fever: a randomized cotrolled trial. Circulation 2001;103:401-406.
30. Meira ZMA et al. Evaluation of secondary prophylactic schemes, based on benzathine penicillin G, for rheumatic fever in children. J Pediatr 1993;123(1):156-158.
31. Amir J et al. Lidocaine as a diluent for administration of benzathine penicillin G. Pediatr Infect Dis J 1998;17(10):890-93.
32. Bisno AL, Brito MO, Collins CM. Molecular basis of group A streptococcal virulence. Lancet Infect Dis 2003;3:191-200.
33. Hu MC et al. Immunogenicity of a 26-valent group A streptococcal vaccine. Infect Immun 2002;70(4):2171-2177.
34. McNeil SA et al. Safety and immunogenicity of 26-valent group A Streptococcus vaccine in healthy adult volunteers. Clin Infect Dis 2005;41:1114-22.
35. Kotloff KL et al. Safety and immunogenicity of a recombinant multivalent group A streptococcal vaccine in healthy adults - Phase I trial. JAMA 2004;292(6):709-715.
36. Stollerman GH. Rheumatic fever in the 21st century. Clin Infect Dis 2001;33:806-14.
37. Martins TB, Veasy LG, Hill HR. Antibody responses to group A streptococcal infections in acute rheumatic fever. Pediatr Infect Dis J 2006;25:832-37.
38. McDonald M, Currie BJ, Carapetis JR. Acute rheumatic fever: a chink in the chain that links the heart to the throat? Lancet Infect Dis 2004;4:240-45.
39. A and group G streptococci and acute rheumatic fever in an Aboriginal population. Lancet 2000;356:1167-69.
40. Martin JM, Barbadora KA. Continued high caseload of rheumatic fever in western Pennsylvania: possible rheumatogenic emm types of Streptococcus Pyogenes. J Pediatr 2006;149:58-63.
41. Carapetis JR, Steer AC, Mulholland EK, Weber M. The global burden of group A Streptococcal diseases. Lancet Infect Dis 2005;5:685-94.
42. Meira ZMA. Prevalence of rheumatic fever in children from a public high school in Belo Horizonte, Brazil. Arq Brasil Cardiol 1995;65:331-334.
43. Tani LY, Veasy LG, Minich LL, Shaddy RE. Rheumatic fever in children younger than 5 years: is the presentation different? Pediatrics 2003;11:1065-1068.
44. Carapetis JR, Currie BJ. Rheumatic fever in a high incidence population: the importance of monoarthritis and low grade fever. Arch Dis Child 2001;85:223-227.
45. Harlan GA, Tani LY, Byington CL. Rheumatic fever presenting as monoarticular arthritis. Pediatr Infect Dis J 2006;25:743-746.
46. Wilson W, et al. Prevention of Infective Endocarditis. Guidelines from the American Heart Association. A Guideline from the American Heart Association Rheumatic Fever, Endocarditis and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007;116:17.1754.
AVALIAÇÃO
1) Em relação à ARTRITE na febre reumática, marque a incorreta:
a) É a manifestação mais comum
b) A dor é proporcional aos achados físicos
c) Acomete preferencialmente grandes articulações e é autolimitada d) Tem ótima resposta aos antiinflamatórios não hormonais
e) Faz diagnóstico diferencial com artrite reativa pós-estreptocócica.
2) São considerados critérios menores para o diagnóstico de Febre Reumática, exceto:
a) Leucocitose
b) Febre
c) Aumento da velocidade de hemossedimentação
d) Aumento de alfa 1 glicoproteína ácida (mucoproteína)
e) Espaço PR maior que 0,2 segundos no ECG
3) Marque a alternativa correta em relação à cardite reumática:
a) O sopro mais freqüente é do tipo sistólico, apical, com irradiação para axila e representa insuficiência mitral.
b) Está frequentemente associada aos nódulos subcutâneos e eritema marginado.
c) Está presente em 100 % dos pacientes com febre reumática
d) Acomete principalmente válvula aórtica seguida de mitral, tricúspide e pulmonar.
e) Depois da doença de Kawasaki, é a principal causa de cardiopatia adquirida nos países em desenvolvimento.
4) Em relação à profilaxia secundária da febre reumática, marque a incorreta:
a) Tem como objetivo impedir recorrências
b) Deve ser feita com penicilina benzatina de 21/21 dias
c) A suspensão vai depender da intensidade e do número de articulações acometidas
d) Paciente sem comprometimento cardíaco encerra a profilaxia aos 18 anos de idade ou 5 anos após o último surto
e) Paciente com comprometimento cardíaco apenas na fase aguda, encerra a profilaxia aos 25 anos ou 10 anos após o último surto.