Número atual: 20(2) - Junho 2020
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Medicamentos manipulados para neonatos
Manipulated drugs for newborns
Marcia Maria Barros dos Passos1; Ana Carolina de Sousa Andrade1; Ana Lucia Vazquez Villa1; Raquel Fonseca Neves2; Mariana Sato de Souza Bustamante Monteiro1
DOI:10.31365/issn.2595-1769.v20i2p37-43
1. Universidade Federal do Rio de Janeiro, Faculdade de Farmácia - Rio de Janeiro - RJ - Brasil
2. Polo de Biotecnologia da UFRJ, Farmácia com Manipulação - Rio de Janeiro - RJ - Brasil
Endereço para correspondência:
Recebido em: 06/03/2020
Aprovado em: 14/07/2020
Instituição:Universidade Federal do Rio de Janeiro, Faculdade de Farmácia - Rio de Janeiro - RJ - Brasil
Resumo
INTRODUÇÃO: Pacientes neonatos internados em Unidades de Terapia Intensiva Neonatal constituem uma população bastante vulnerável à adaptação de formas farmacêuticas, uma vez que são escassos medicamentos com formas farmacêuticas adequadas para essa população.
OBJETIVO: Descrever as prescrições de medicamentos manipulados para pacientes neonatos e verificar sua preparação farmacotécnica.
MÉTODO: Estudo descritivo retrospectivo. Os dados foram obtidos de prescrições de pacientes oriundos de seis hospitais do Rio de Janeiro, atendidas em uma farmácia com manipulação no período entre junho e novembro de 2017.
RESULTADOS: O estudo incluiu 51 prescrições, contemplando 57 formulações de 17 diferentes fármacos. Todas as formulações foram preparadas em formas farmacêuticas de administração oral. Destas, 65 % na forma de solução aquosa, 24,5 % de suspensão e 10,5 % de xarope. Os fármacos cafeína 36,85%, captopril 7,1% e piridoxina 5,3% foram os mais frequentes em forma de solução. Como suspensão, a coenzima Q10 com 7,1% foi a mais frequente, e dentre os veículos com sacarose, o propranolol com 7,1%. Dentre os excipientes, a glicerina (58,0%) foi o mais utilizado. Foram utilizados os mínimos de excipientes para estabilizar as formulações, considerando a pouca evidência da utilização de fármacos e excipientes para uso nessa faixa etária.
CONCLUSÕES: Todos os fármacos descritos nas formulações destinavam-se a formas farmacêuticas líquidas. O desenvolvimento dessas formulações permitiu atender às necessidades específicas de cada paciente, requerendo, entretanto, o uso de excipientes os mais inócuos possíveis.
Palavras-chave: Recém-nascido; Medicamentos manipulados; Farmácia.
Abstract
INTRODUCTION: Newborn patients admitted to Neonatal Intensive Care Units are very vulnerable to pharmaceutical forms since there are few drugs with adequate pharmaceutical forms for this population.
OBJECTIVE: To describe the prescriptions of pharmaceutical compounding for newborn patients and to verify their pharmaco-technical preparation.
METHOD: Retrospective descriptive study. Data were obtained from prescriptions of patients from six hospitals in Rio de Janeiro, attended at a pharmacy with handling between June and November 2017.
RESULTS: The study included 51 prescriptions, comprising 57 formulations of 17 different drugs. All formulations were prepared in pharmaceutical forms for oral administration. Of these, 65% in the form of aqueous solution, 24.5% of suspension and 10.5% of syrup. The drugs caffeine 36.85%, captopril 7.1%, and pyridoxine 5.3% were the most frequent as solution. As suspension, coenzyme Q10 with 7.1% was the most frequent, and among vehicles with sucrose, propranolol with 7.1%. Among the excipients, glycerin with 58,0% was the most used. Excipient minimums were used to stabilize the formulations, given the little evidence of the use of drugs and excipients for use in this age group.
CONCLUSIONS: All drugs described in the formulations were intended for liquid dosage forms. The development of these formulations allowed to meet the specific needs of each patient, requiring, however, the use of excipients as harmless as possible.
Keywords: Newborn; Pharmaceutical compounding dugs; Pharmacy.
INTRODUÇÃO
Os pacientes neonatos internados em unidades de terapia intensiva neonatal (UTIN) constituem uma população bastante vulnerável à utilização de medicamentos manipulados, devido à carência de medicamentos industrializados em formas farmacêuticas e concentrações adequadas para uso nessa população.1 Para atender a essa demanda, as farmácias com manipulação desenvolvem formulações por meio de transformações de formas farmacêuticas sólidas de uso adulto em formas líquidas para uso oral com ajuste de doses.2
No entanto, essa condição caracteriza uso off label ou não licenciado, uma vez que tal termo se refere a qualquer situação de uso diferente da indicação autorizada no registro, a qual inclui a administração por via diferente da preconizada, administração para faixas etárias para o qual o medicamento não foi testado e posologias não usuais.3 Por esse motivo, estima-se que medicamentos não licenciados ocorram em cerca de 90% das prescrições em pediatria e 98% das prescrições em neonatologia.4
O limitado número de estudos clínicos farmacológicos destinados à população pediátrica dificulta a autorização de registro de medicamentos industrializados para esse grupo, tendo como consequência a indisponibilidade de medicamentos mais apropriados para uso em crianças e recém-nascidos. Dessa forma, a prescrição de medicamentos para recém-nascidos tem sido baseada em extrapolações e adaptações de dados obtidos em crianças maiores e adultos.5 No entanto, embora esses medicamentos possam ser preparados extemporaneamente para uso em pacientes individuais, as propriedades físicas e químicas dos fármacos e excipientes sempre devem ser consideradas ao preparar formulações extemporâneas, já que tais formulações podem carecer de estudos para documentar estabilidade, biodisponibilidade, farmacocinética, farmacodinâmica, eficácia e tolerabilidade.6 Nesse contexto, descrever, estudar e compartilhar informações sobre medicamentos manipulados para neonatos pode contribuir para o conhecimento científico, visto que a manipulação de preparações extemporâneas tem sido uma prática comum e necessária na farmácia pediátrica, para contemplar medicamentos essenciais em doses e formas farmacêuticas personalizadas.7
O presente trabalho tem por objetivo descrever os resultados das prescrições de medicamentos manipulados para pacientes neonatos, em UTINs atendidos em uma farmácia com manipulação, identificar as formulações encontradas e verificar sua preparação farmacotécnica.
MATERIAL E MÉTODO
Trata-se de estudo descritivo retrospectivo, realizado no período de junho a novembro de 2017. Todas as prescrições de medicamentos magistrais para neonatos e suas fichas de produção foram analisadas, permitindo determinar a frequência dos fármacos, veículos, excipientes e sua preparação magistral. O desfecho primário estimado para a pesquisa foi o tipo de fármaco prescrito e sua preparação magistral.
Preparação magistral é aquela preparada na farmácia, a partir de uma prescrição de profissional habilitado, destinada a um paciente individualizado, e que estabeleça em detalhes sua composição, forma farmacêutica, posologia e modo de usar.8
A pesquisa foi realizada em uma farmácia com manipulação, situada em um polo de biotecnologia da Universidade Federal do Rio de Janeiro que atende prescrições de pacientes neonatos, pediátricos e adultos oriundos de diversas unidades hospitalares do município e região metropolitana do Rio de Janeiro. O estudo arrolou prescrições oriundas de seis hospitais da região metropolitana do Rio de Janeiro atendidas no período de estudo. Dentre os hospitais, dois são especializados do tipo materno-infantil e quatro do tipo geral, sendo cinco de natureza privada e apenas um público com atendimento ao Sistema Único de Saúde (SUS).
Foram excluídas as prescrições de pacientes que não apresentavam informação referente à data de nascimento ou com idade superior a 28 dias. Os dados foram coletados e registrados em planilha, ordenados pelas variáveis do medicamento (fármaco, concentração, forma farmacêutica, via de administração, excipientes), do paciente (idade, sexo), identificação das etapas de preparação dos medicamentos (tipo de veículo, grau de toxicidade dos excipientes).
Para análise das preparações, foram observados os excipientes utilizados em cada forma farmacêutica e sua pertinência para uso em neonato. Os dados coletados foram armazenados em planilha eletrônica, por meio do programa computacional Microsoft Office Excel® 2010, e foi utilizada estatística descritiva simples para análise dos dados. Para variável contínua "idade", foram calculados média, mediana e desvio padrão, e para as variáveis categóricas relacionadas às características dos medicamentos, foram calculadas as frequências absolutas e relativas.
O projeto de pesquisa foi submetido à Plataforma Brasil e aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (CAAE: 79473517.2.0000.5257), em 21 de dezembro de 2017, sob parecer número 2.453.342, de acordo com a Resolução n. 466, de 12 de dezembro de 2012, que dispõe sobre as normas vigentes para a pesquisa em seres humanos no Brasil.
RESULTADOS
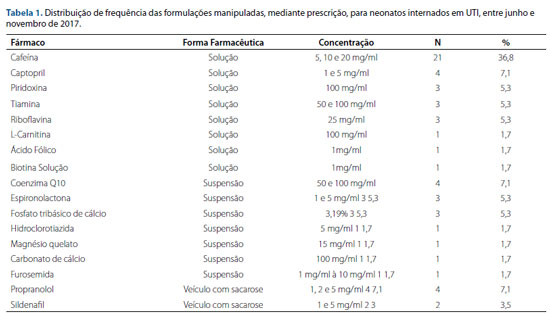
O estudo analisou 51 prescrições de 42 pacientes internados em UTIN. Dentre estes, 40% eram do sexo masculino, a amplitude da idade variou de 02 a 27 dias (média de 15,58; desvio padrão de 8,1 dias e mediana de 16,0 dias). Durante o período de investigação, foram verificadas 57 formulações prescritas, com 17 diferentes fármacos (Tabela 1). Todas as formulações magistrais foram preparações de uso oral ou enteral. A forma farmacêutica solução foi predominante correspondendo a 65% (n = 37), seguido de suspensão com 24,5% (n = 14) e veículo com sacarose com 10,5% (n = 6).
Foram preparadas soluções para os fármacos cafeína (n= 21), captopril (n = 4), piridoxina (n = 3), tiamina (n = 3), riboflavina (n = 3), L-carnitina (n = 1) e biotina (n=1) e ácido fólico (n=1). Já as suspensões foram preparadas para veicular os seguintes fármacos: coenzima Q10 (n = 4), espironolactona (n = 3), fosfato tribásico de cálcio (n = 3), hidroclorotiazida (n = 1), magnésio quelado (n = 1), carbonato de cálcio (n = 1) e furosemida (n = 1). Os veículos com sacarose veicularam os fármacos: propranolol (n = 4), sildenafil (n = 2).
Quanto aos excipientes farmacêuticos, foi utilizada a glicerina (n=33) em concentrações de 5, 10, 20, 25 e 50%; ácido cítrico anidro (n=25), vitamina C revestida 0,5% (n=4), propilenoglicol 5% (n=1), ascorbato de sódio (n = 4) e benzoato de sódio (n=1). Como veículo, foram utilizados: CMC com glicerina (n=26), veículo com sacarose (n= 6), água purificada (n = 32) com conservante benzoato de sódio (n=1).
No processo de manipulação, foram observados o grau de toxicidade dos excipientes, os tipos de veículos utilizados, restrições no armazenamento do medicamento e técnicas de manipulação para obtenção dos medicamentos. Em relação ao grau de toxicidade dos excipientes, destaca-se a suspensão de hidroclortiazida, no qual foi necessário utilizar propilenoglicol como facilitador da homogeneização da preparação. Em relação ao veículo, a formulação mais crítica foi a suspensão de magnésio quelado a 30%, na qual foi necessária utilizar um veículo com o conservante benzoato de sódio a 0,05%. Outro veículo necessário foi a sacarose, pois as formulações com sildenafil e propranolol foram desenvolvidas com xarope simples, o qual contém sacarose. Em relação às restrições no armazenamento, a solução de piridoxina foi a que demandou maior atenção, por ser um fármaco termolábil e fotossensível, sendo necessário seu acondicionamento em frasco âmbar. Em relação à técnica de manipulação, a solução de cafeína necessitou de ácido cítrico anidro, como antioxidante, e da hidratação da cafeína em um pequeno volume de água junto com o acido cítrico, para sua completa solubilização antes do preparo da solução. A dissolução do captopril se deu sem trituração, devido à possibilidade de polimorfismo, que poderia alterar sua forma cristalina, alterando a solubilidade do fármaco. Por fim, a solução da L-carnitina necessitou da glicerina para levigar o fármaco na preparação.
As formulações manipuladas verificadas neste estudo eram extemporâneas e apresentavam uma estabilidade breve. A validade dos medicamentos foi estimada para aproximadamente 30 dias para captopril, piridoxina, tiamina, riboflavina, biotina e propranolol sob a temperatura de refrigeração (8°C) e ácido fólico e magnésio quelado em temperatura ambiente (24°C). Para 60 dias de validade, cafeína, L-carnitina, espironolactona e furosemida sob refrigeração, e hidroclortiazida e carbonato de cálcio em temperatura ambiente.
DISCUSSÃO
O presente estudo incluiu prescrições de pacientes neonatos com média de idade de 15 dias, de ambos os sexos, oriundos em sua maioria de hospitais privados da região metropolitana do Rio de janeiro. Porém, a comparação com outros estudos não foi possível, dadas as diferenças metodológicas. Autores que realizaram estudo sobre medicamentos manipulados para pacientes recém-nascidos expressaram seus resultados citando apenas grupo etário, sem detalhamento do sexo e idade dos neonatos.3,5,9,12
Os fármacos cafeína, furosemida, captopril, propranolol e coenzima Q10 foram os medicamentos manipulados mais prescritos em formulações líquidas orais para pacientes neonatos. Resultado semelhante a outros estudos nacionais e internacionais.12,13 Estudos brasileiros também verificaram que captopril, sildenafil, espironolactona, furosemida, fosfato tricálcico, ácido fólico, cafeína e L-carnitina foram manipulados em formulações líquidas para administração oral para crianças,9,14 neonatos19 e neonatos prematuros.12
Estudo realizado em hospital público pediátrico verificou que captopril, carbonato de cálcio, espironolactona, hidroclorotiazida, propranolol e furosemida foram fármacos apontados como necessários nas formas farmacêuticas líquidas para uso em pediatria no Ceará, Brasil.5 Outro estudo realizado em UTIN de um hospital universitário terciário do Rio de Janeiro, Brasil,3 destacou os fármacos sildenafil, hidroclorotiazida, cafeína e captopril como os mais utilizados. Dentre os fármacos que atuam no sistema cardiovascular, furosemida, hidroclorotiazida, espironolactona, propranolol e captopril foram exemplos de medicamentos utilizados por pacientes pediátricos e neonatos.3
Em relação às formas farmacêuticas, o presente estudo verificou que 100% das formulações manipuladas para neonatos foram formas farmacêuticas líquidas, como soluções, suspensões e xaropes.
Outros estudos também encontraram resultados semelhantes sobre medicamentos magistrais para neonatos em UTI.3,5,7 Estudo realizado por Souza-Pereira et al.3 verificou alto consumo (70,0%) de soluções e suspensãoes magistrais para administração oral em neonatos internados em UTIN. Costa et al.,5 que investigaram prescrição e preparo de medicamentos sem forma farmacêutica adequada para crianças, observaram 119 adaptações de medicamentos de forma sólida de uso adulto para forma líquida para admisistração pediátrica, sendo preparações extemporâneas para utilização em até 48 horas mantidas sob refrigeração.
Estudos indicam que a dificuldade de ingestão de formas sólidas por essa população, assim como a facilidade de administração das formas líquidas, além de outros fatores como absorção mais rápida, possibilidade de mascarar o odor e sabor dos ativos e possibilidade de ajuste de dose dentre outros justificam essa preferência.3,9 Entretanto, viabilizar tais formulações em veículo aquoso, contendo o mínimo de adição de excipientes, é um desafio farmacêutico, visto que é necessário buscar a estabilidade do produto, mas também considerar as vulnerabilidades dos recém-nascidos. Neste contexto, foi encontrada na literatura a possibilidade de se obter soluções e suspensões orais magistrais por meio de trituração de comprimidos, da utilização do pó contido em cápsula ou mesmo da diluição de uma solução injetável em veículo aquoso, buscando a concentração desejada por volume.3,7 Entretanto, tal procedimento pode comprometer a estabilidade das substâncias ativas, além de expor os pacientes a altas concentrações de excipientes, uma vez que os produtos de partida para a preparação são medicamentos industrializados de uso adulto, podendo conter corantes e conservantes que não são convenientes para pacientes neonatos.
Segundo Pinto et al.,7 a pulverização de comprimidos ou a abertura de cápsulas para a obtenção de suspensões farmacêuticas pode em certos casos comprometer a estabilidade do ativo, devido ao aumento da superfície de exposição ao dispersante. Além disso, no caso de comprimidos revestidos, sua pulverização não é tecnicamente indicada, visto que o revestimento tem a função de proteger o ativo de degradação devido à presença do suco gástrico. Portanto, o ideal é desenvolver a formulação a partir do insumo farmacêutico ativo, considerando, além dos fatores farmacotécnicos, também as características dos pacientes.7-8,11
No processo de obtenção das formulações magistrais mencionadas neste estudo, foi necessário utilizar os excipientes glicerina, ácido cítrico anidro, ácido ascórbico, ascorbato de sódio, propilenoglicol, benzoato de sódio, carboximetilcelulose e xarope simples. A glicerina foi o excipiente mais utilizado neste estudo, dada sua versatilidade de poder atuar como solvente, cossolvente, edulcorante, conservante antimicrobiano, agente doador de viscosidade e veículo em formulações farmacêuticas. Esta geralmente não está associada a efeitos adversos, sendo considerado um material não tóxico e não irritante. Porém, em altas doses podem produzir dor de cabeça, sede, náusea e hiperglicemia. Essa substância é absorvida no intestino e metabolizada em dióxido de carbono e glicogênio ou utilizada na síntese de gorduras corporais.17 Esse excipiente foi utilizado na solução da L-carnitina para levigar o ativo e permitir sua incorporação na formulação. Estudo semelhante3 identificou a exposição de pacientes neonatos em UTIN ao excipiente glicerina.
O ácido cítrico é um agente acidulante, antioxidante, corretor de pH, quelante, flavorizante e conservante, e foi utilizado na solução de cafeína, como acidulante e antioxidante, para obter uma solução aquosa límpida e incolor com pH em torno de 4,7. Além disso, foi necessário manter a cafeína em um pequeno volume de água junto com o acido cítrico, para sua completa solubilização antes do preparo da solução. Geralmente, o ácido cítrico é considerado não tóxico quando utilizado como excipiente, mas seu uso excessivo tem sido associado à erosão dos dentes.17
O ascorbato de sódio foi utilizado como agente antioxidante na preparação de solução de captopril, e não há relatos na literatura associando-o a efeitos adversos quando empregado em baixas concentrações.17 O ácido ascórbico também é um antioxidante e nenhum efeito adverso foi relatado nos níveis empregados em produtos farmacêuticos.17
O propilenoglicol pode atuar como solvente ou cossolvente, conservante antimicrobiano e agente estabilizante. É utilizado em uma ampla variedade de produtos farmacêuticos, geralmente considerado como relativamente não tóxico. Provavelmente, como consequência do seu metabolismo e excreção, o propilenoglicol é menos tóxico que outros glicóis, pois é rapidamente absorvido do trato gastrointestinal. Contudo, sua administração em grandes volumes está associada a efeitos adversos no sistema nervoso central.17-19 Dentre as preparações aqui descritas, foi utilizado em pequena concentração para viabilizar a dispersão da hidroclortiazida na forma de suspensão.
O benzoato de sódio é considerado seguro em concentração até 5%. Pode, no entanto, produzir urticária e reação de contato imediata, não imunológica, além de ser utilizado no tratamento de distúrbios metabólicos em neonatos.17-19 Na suspensão de magnésio quelado 30%, foi utilizado um veículo aquoso com o conservante benzoato de sódio a 0,05%, para aumentar a estabilidade da formulação. O benzoato de sódio é utilizado em formulações líquidas, como conservante antimicrobiano em formulações farmacêuticas orais.17 Em similaridade a este estudo, foi relatado que pacientes neonatos em UTINs, sobretudo os recém-nascidos prematuros, receberam medicamentos que continham excipientes como propilenoglicol e benzoato de sódio.17-20
A carboximetilcelulose atua como agente estabilizante, agente suspensor, agente de aumento de viscosidade. É um material não tóxico e não irritante. Porém, a ingestão oral de uma grande quantidade, entre 4 g e 10 g, pode provocar efeito laxativo.17
No presente estudo, os excipientes foram utilizados dentro da dose segura, visto que alguns desses excipientes quando utilizados em altas doses em neonatologia podem apresentar alguns efeitos adversos. Isso deve ser considerado como um ponto crítico na manipulação, pois um estudo realizado na Espanha verificou que 62% das formulações orais administradas em neonatos apresentavam excipientes inadequados.21
A maioria das formulações continha carboxime tilcelulose (CMC) e glicerina. A CMC é um polímero utilizado como agente suspensor e doador de viscosidade em formulações farmacêuticas, para garantir uma viscosidade aceitável e adequada para a administração da forma farmacêutica. Além disso, modificações na viscosidade de líquidos, por meio de agentes espessantes, tem sido uma estratégia utilizada para promover uma deglutição mais favorável para o recém-nascido, pois dificulta o escape para a orofaringe e melhor coordenação da deglutição.22 Outro ponto que deve ser considerado é a propriedade bio(muco)adesiva do CMC, que favorece a capacidade de aderir as glicoproteínas do muco durante um período de tempo, intensificando o contato do fármaco com a mucosa, favorecendo sua absorção.17
No desenvolvimento de uma forma farmacêutica isenta de açúcar, pode-se substituir a sacarose por substâncias doadoras de viscosidade, como a CMC, e para melhorar o dulçor da formulação, adiciona-se a glicerina. Líquidos e xaropes que contêm polímero na sua composição podem ter sua viscosidade aumentada, o que contribui para a estabilidade das formulações e facilidade para sua administração.17
O xarope simples é uma forma farmacêutica preparada à base de açúcar e água, em que o açúcar está próximo à saturação. No entanto, o uso prolongado de medicamentos com sacarose pode causar problemas na cavidade bucal, além de problemas de metabolização em neonatos. O xarope simples foi utilizado para desenvolver as formulações de sildenafil e propranolol na quantidade mínima necessária para viabilizar a formulação.
Dentre os fármacos manipulados neste estudo, apenas cafeína e a furosemida são licenciadas pela ANVISA para uso nessa faixa etária. No Brasil, o citrato de cafeína está licenciado com nome apresentação comercial Peyona como solução para infusão intravenosa ou oral, em concentração de 20 mg/mL. A cafeína foi o medicamento mais prescrito para pacientes neonatos admitidos em UTIN,12 para neonatos pré-termo3 e para recém-nascidos extremamente prematuros e muito prematuros,13 sendo utilizado como preparação extemporânea, apesar da disponibilidade de um produto comercial autorizado.12 Observa-se que a possibilidade do ajuste de dose e da forma farmacêutica, assim como o menor custo do medicamento manipulado, justifica a preferência pelo manipulado.12,13 A furosemida encontra-se disponível no Brasil em solução injetável 10 mg/ml e comprimido de 40 mg. Está licenciada na ANVISA com indicação de uso por via oral em lactentes e crianças menores de 15 anos de idade. Sua preparação extemporânea tem sido descrita na literatura na forma de suspensão, tendo sua estabilidade física e química comprovada quando se utiliza conservante e é mantida sob refrigeração.6
Finalmente, é preciso destacar que a manipulação de medicamentos tem papel fundamental na obtenção dos medicamentos viáveis para a farmacoterapia na neonatologia, uma vez que o desenvolvimento de formulações extemporâneas pode contemplar a grande carência de formulações adequadas para uso em neonatos.
Esta pesquisa apresenta como possíveis limitações o número de prescrições estudadas, que restringiu o elenco de formulações e insumos farmacêuticos ativos, que poderia ter sido mais amplo. Entretanto, por tratar-se de estudo retrospectivo, houve a limitação em relação aos dados de registro.
CONCLUSÃO
Foi possível conhecer os fármacos prescritos e verificar sua preparação farmacotécnica e os excipientes utilizados. O desenvolvimento dessas formulações líquidas permitiu atender às necessidades específicas de cada paciente, requerendo, entretanto, o uso de excipientes o mais inócuo possível, minimizando possíveis efeitos adversos relacionados. Além disso, indicaram-se as formulações e principais adaptações no que se refere à técnica de preparo e acondicionamento, contribuindo para maior segurança dos pacientes e qualidade da manipulação farmacêutica. Denota-se, dessa forma, a importância do medicamento magistral nessas condições; do contrário, os tratamentos estariam inviabilizados.
Ressalta-se que, embora as preparações magistrais viabilizem os tratamentos em forma farmacêutica e concentrações adequadas aos pacientes, tais produtos são extemporâneos e devem ser utilizados em um tempo mais breve possível, sendo fundamental que a indústria farmacêutica venha a produzir esses medicamentos em forma farmacêutica adequada para essa população.
REFERÊNCIAS
1. Balan S, Hassali MA, Mak VSL. Challenges in pediatric drug use: a pharmacist point of view. Res Social Adm Pharm. 2017; 13(3):653-655.
2. Souza Pereira A.C. et al. Medicamentos magistrais em recém-nascidos e crianças hospitalizados. Rev Paul Pediatr. 2016; 34(4):403-407.
3. Carvalho CG, Ribeiro MR, Bonilha MM, Fernandes Jr M, Procianoy RS, Silveira RC. Use of off-label and unlicensed drugs in the neonatal intensive care unit and its association with severity scores. J Pediatr. 2012; 88(6):465-70.
4. Magalhães J, Rodrigues AT, Roque F, Figueiras A, Falcão A, Herdeiro MT. Use of off-label and unlicenced drugs in hospitalised paediatric patients: a systematic review. Eur J Clin Pharmacol. 2015; 71:1-13.
5. Costa PQ, Lima JES, Coelho HLL. Prescrição e preparo de medicamentos sem formulação adequada para crianças: um estudo de base hospitalar. Brazilian Journal of Pharmaceutical Sciences. 2009; 45(1):57-66.
6. Nahata MC, Allen Jr LV. Extemporaneous drug formulations. Clinical Therapeutics. 2008; 30(11):2112-2119.
7. Pinto S, Barbosa CM. Medicamentos manipulados em pediatria, estado actual e perspectivas futuras. Arquivos de Medicina. 2008; 22(33):75-84.
8. BRASIL. Agência Nacional de Vigilância Sanitária. Resolução - RDC nº 67, de 8 de outubro de 2007. Regulamento Técnico sobre Boas Práticas de Manipulação de Preparações Magistrais e Oficinais para uso Humano em Farmácia e seus Anexos. Diário Oficial da União, Brasília, n. 195, p.2 9-58, 9 out 2007. Disponível em: <http://portal.anvisa.gov.br>. Acesso em: 28 fev. 2015.
9. Blanco-Reina E, Medina-Claros AF, Veja-Jiménez MA, Ocana-Riola R, Márquez-Romero EI, Ruiz Extremara A. Utilización de fármacos en niños en cuidados intensivos: estudio de las prescripciones off-label. Med Intensiva. 2016; 40(1):1-8.
10. Britto JF et al. Utilização de preparações magistrais extemporâneas em pacientes pediátricos de um hospital público. Rev. Saúde.Com. 2017; 13(1):797-805.
11. Nahata MC. Safety of ''inert'' additives or excipients in paediatric medicines. Arch Dis Child Fetal Neonatal. 2009; 94(6):392-3.
12. Cuzzolin L, Agostino R. Off-label and unlicensed drug treatments in Neonatal Intensive Care Units: an Italian multicentre study. Eur J Clin Pharmacol. 2016; 72:117-123. DOI 10.1007/s00228-015-1962-4
13. Schweigertova J, Durisova A, Dolnikova D, Ondriasova E, Balazova M. Off-label and unlicensed use of medicinal products in the neonatal setting in the Slovak Republic. Pediatrics International. 2016; 58: 126-13.
14. Costa PQ, Rey LC, Coelho HL. Lack of drug preparations for use in children in Brazil. Jornal de Pediatria, Rio de Janeiro. 2009; 85(3):229-235.
15. Sathapanapitagkit N, Prokati M, Leanpolchareanchai J, Chantasart D, Laohajeeraphan M, Suksiriworapong J. Chemical and physical stability investigations of captopril extemporaneous suspension for oral administration. Mahidol Univ J Pharm Sci. 2015; 42(3):126-134.
16. Ji Y, Chen S, Xiang B, Yang Y, Qiu L. Safety and tolerance of propranolol in neonates with severe infantile hemangiomas: a prospective study. Scientific Reports. 2017; 7(1503):1-8.
17. Rowe RC, Sheskey PJ, Quinn ME. Handbook of Pharmaceutical Excipients. 6. ed. Pharmaceutical Press. 2009.
18. Nellis G, Metsvaht T, Varendi H, Toompere K, Lass J, Mesek I, NunnAJ, Turner MA, Lutsar. Potentially harmful excipients in neonatal medicines: a pan-European observational study. Arch Dis Child. 2015; 100(7):694-699.
19. Souza Jr, A, Santos D, Fonseca S, Medeiro s M, Batista L, Turner M, Coelho H. Toxic excipients in medications for neonates in Brazil. Eur J Pediatr. 2014; 173(7):935-945.
20. Sherab N, Lewis CL, Streetman DD, Donn SM. Exposure to the pharmaceutical excipients benzyl alcohol and propylene glycol among critically ill neonates. Pediatr Crit Care Med. 2009; 10(2):256-259.
21. Garcia-Palop B, Polanco EM, Ramirez CC, Poy MJC. Harmful excipients in medicines for neonates in Spain. Int. J Clin Pharm. 2016; 38(2):238-242.
22. Carvalho CG, Ribeiro MR, Bonilha MM, Fernandes Jr M, Procianoy RS, Silveira RC. Use of off-label and unlicensed drugs in the neonatal intensive care unit and its association with severity scores. Jornal de Pediatria, Rio de Janeiro. 2012; 88(6):465-70