Número atual: 18(3) - Setembro 2018
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
ARTIGOS ORIGINAIS
Perfil das hemoculturas de crianças admitidas em hospital pediátrico do Rio de Janeiro
Blood cultures profile of children admitted in pediatrics hospital of Rio de Janeiro
André Ricardo Araujo da Silva1; Igor Duque Gonçalves da Silva1; Juliana de Freitas Fonseca1; Nicole Maria Davi Gonçalves1; Laene Oliveira Gomes2; Cristiane Henriques Teixeira2
DOI:10.31365/issn.2595-1769.v18i3p2-7
1. Universidade Federal Fluminense
2. Prontobaby - Hospital da Criança
Endereço para correspondência:
Recebido em: 22/5/2018
Aprovado em: 10/9/2018
Instituiçoes: Universidade Federal Fluminense, Niterói - RJ e Prontobaby - Hospital da Criança, Rio de Janeiro - RJ
Resumo
INTRODUÇÃO: as hemoculturas são consideradas o padrão-ouro para detectar infecções de corrente sanguínea.
OBJETIVO: descrever os resultados das hemoculturas coletadas durante um ano de seguimento em um hospital pediátrico.
MÉTODOS: conduzimos um estudo transversal em um hospital terciário pediátrico do estado do Rio de Janeiro, realizando uma análise descritiva sobre a taxa de positividade e contaminação das amostras e das bactérias multirresistentes encontradas.
RESULTADOS: no ano de 2016, foram coletadas 2.668 hemoculturas, das quais 1.445 (54,2%) das enfermarias de pediatria, 949 (35,6%) oriundas da unidade de terapia intensiva pediátrica e 274 (10,3%) da unidade de terapia intensiva neonatal. Cento e sete hemoculturas foram positivas (4% do total), sendo o percentual de positividade maior na unidade de terapia intensiva pediátrica (46/949; 4,8%) [IC 95% de 0,4581 a 3,7163] quando comparada ao encontrado (41/1.445; 2,8%) nas enfermarias de pediatria (p = 0,0101) e na unidade de terapia intensiva neonatal (20/274; 7,3%) [IC 95% de 1,7902 a 8,2775] também comparada às enfermarias de pediatria (p = 0,0002). Do total de isolados positivos, 33/107 (30,8%) apresentaram perfil de multirresistência e, entre estes, o Staphylococcus aureus resistente à meticilina foi o mais frequentemente isolado (27/33; 81,8%). O Staphylococcus aureus resistente à meticilina foi o agente mais isolado tanto na unidade de terapia intensiva pediátrica quanto na unidade de terapia intensiva neonatal com 27 e 12 isolados, respectivamente. Em 151 (5,7%) amostras foram encontrados três ou mais germes, ou germes classificados como contaminantes de pele.
CONCLUSÕES: concluímos que a positividade global das hemoculturas foi baixa, sendo verificada maior proporção de amostras positivas nas unidades críticas.
Palavras-chave: Hemocultura; Pediatria; Infecçao hospitalar.
Abstract
INTRODUCTION: blood cultures are the golden standard to detect bloodstream infections.
OBJECTIVE: to describe results of blood cultures collected during one year of follow-up in a pediatric hospital.
METHODS: we carried out a cross-sectional, retrospective study at a tertiary pediatric hospital in the state of Rio de Janeiro, Brazil, performing a descriptive analysis about positive and contaminated rate of samples, and multi-drug resistant (MDR) bacteria found.
RESULTS: in the year of 2016, 2,668 blood cultures were collected, being 1,445 (54.2%) collected from pediatric wards, 949 (35.6%) from pediatric intensive care unit (PICU) and 274 (10.3%) from neonatal intensive care unit (NICU). One hundred and seven blood cultures were positive (4% of total), with a positive rate higher in PICU (46/949 - 4.8%) [95% CI - 0.4581 to 3.7163] when compared to (41/1,445 - 2.8%) pediatric wards (p = 0.0101), and NICU (20/274 - 7.3%) [95% CI 1.7902 to 8.2775] also when compared with pediatric wards (p = 0.0002). Thirty-three positive samples (30.8% of total) presented a multi-drug resistant (MDR) profile and among them, MRSA was the most frequently isolated agent (27/33 - 81.8%). MRSA was the most common MDR bacteria isolated in both PICU and NICU, with 27 and 12 isolates, respectively. In one hundred and fifty-one (5.7%) samples, three or more germs, or agents classified as contaminating skin germs, were found.
CONCLUSIONS: we conclude that the global rate of positive blood cultures was low, with a higher rate of positive samples verified in the critical units.
Keywords: Blood culture; Pediatrics; Cross infection.
INTRODUÇÃO
A hemocultura é um dos exames mais comuns na prática pediátrica, sendo considerado o teste ideal e padrão-ouro para o diagnóstico de infecção de corrente sanguínea e bacteremia.1,2 O exame é usado frequentemente pelos clínicos para guiar as decisões terapêuticas, principalmente em relação à identificação do agente causador, permitindo assim a instituição de antibioticoterapia adequada o mais precocemente possível, o que pode diminuir o tempo de internação e os coeficientes de letalidade, sendo que a promoção de boas práticas na coleta de sangue e a solicitação de hemocultura deve ser reservada a situações de clínica evidente ou fatores de risco, sejam eles da própria criança, sejam fatores maternos.3,4,5
As infecções primárias de corrente sanguínea são aquelas infecções de consequências sistêmicas graves, bacteremia ou sepse, sem foco primário identificável. A infecção de corrente sanguínea secundária é, por sua vez, a ocorrência de hemocultura positiva ou sinais clínicos de sepse, na presença de sinais de infecção em outro sítio.1
Vários aspectos influenciam na positividade do exame, como técnica no momento da coleta, volume de sangue coletado, número de amostras coletadas, transporte das amostras até a chegada ao laboratório, tecnologia empregada na identificação dos agentes infecciosos e processamento interno no laboratório de microbiologia.2 Dessa forma, a possibilidade tanto de falso-positivos quanto de falso-negativos pode ser um dificultador para a interpretação dos resultados obtidos.2,6,7
O isolamento de germes considerados contaminantes de pele é outro aspecto bastante comum tanto em neonatologia quanto na pediatria, o que dificulta a correlação com a clínica dos pacientes e a tomada de decisão. São considerados como contaminantes de pele: Corynebacterium spp (excluindo o C. diphtheriae); Bacillus spp (excluindo B. anthracis); Propionibacterium spp; Staphylococcus coagulase negativa; Streptococcus do grupo viridans; Aerococcus spp; e Micrococcus spp.1 Destes agentes, o S. coagulase negativo é frequentemente reportado como agente mais comum isolado em hemoculturas.8,9 A contaminação de hemoculturas pode prolongar a permanência hospitalar entre 1 e 5,4 dias, ocasionando custos financeiros adicionais e prejuízos para os sistemas de saúde.10,11
Os germes da pele estão ao redor dos cateteres em toda a superfície que circunda os orifícios em que são inseridos os dispositivos, e essa flora extraluminal é, normalmente, a que mais é conduzida até a corrente sanguínea. Com isso, 45% das bactérias carregadas são levadas através das mãos dos profissionais para a corrente sanguínea.11,12 Outro estudo sugere, ainda, que a contaminação das amostras (ou falso-positivos) teve alguma relação com a idade dos pacientes e, possivelmente, com as dificuldades técnicas para a coleta da amostra de sangue, já que os resultados falso-positivos foram encontrados apenas em menores de um ano de idade dentro da população pediátrica analisada.13
Outro aspecto ainda não esclarecido totalmente em pediatria e neonatologia é a taxa aceitável de contaminação em hemoculturas pediátricas. Em adultos, esse valor usualmente é convencionado em até 3% das amostras.5,14
Considerando tais aspectos, o objetivo deste trabalho é descrever o resultado das hemoculturas coletadas em um hospital pediátrico, durante um ano de seguimento e identificar os principais agentes infecciosos encontrados e a taxa de contaminação das amostras.
MÉTODOS
A seguir apresentaremos detalhadamente os métodos empregados no estudo.
CENÁRIO/POPULAÇÃO DE ESTUDO
Realizamos um estudo descritivo, retrospectivo a respeito do perfil de hemoculturas coletadas em um hospital pediátrico do estado do Rio de Janeiro. O hospital Prontobaby é uma entidade privada, localizada na Zona Norte do Município do Rio de Janeiro e dispõe de 135 leitos, sendo 34 destinados à terapia intensiva pediátrica e dez à unidade de tratamento intensivo (UTI) neonatal. Atualmente, é o maior hospital exclusivamente pediátrico do estado. Todos os pacientes internados são referidos da própria emergência ou de outras unidades (públicas e/ou privadas).
CRITÉRIOS DE INCLUSÃO/EXCLUSÃO
Foram incluídas no estudo todas as hemoculturas coletadas no hospital, em todos os setores, entre 1º de janeiro e 31 de dezembro de 2016. Foram excluídas da análise hemoculturas sem resultados disponíveis.
COLETA/PROCESSAMENTO DE AMOSTRAS
A técnica de coleta de hemocultura na instituição é padronizada e consiste de desinfecção da pele por 20 a 30 segundos antes da coleta das culturas, com clorexidina alcoólico ou álcool a 70%. Após a secagem espontânea da pele, o sangue coletado através de escalpe estéril foi inoculado nos frascos de hemocultura padronizados no hospital (PROBAC®) e incubados a 37 °C por cinco dias.
A solicitação das amostras ficou a cargo dos médicos-assistentes, conforme suspeita clínica, sendo o processamento das amostras realizado pela equipe do laboratório de microbiologia do hospital. A identificação dos germes e determinação da concentração inibitória mínima (CIM) dos agentes encontrados foram obtidos através da utilização do aparelho MicroScan autoScan-4 Siemens®. Em algumas situações, nas quais o método semiautomatizado não foi capaz de realizar a identificação dos patógenos, foi realizado o processamento manual das culturas e análise do perfil de sensibilidade antimicrobiana por meio do teste de disco-difusão, conforme os padrões descritos pelo Clinical and Laboratory Standard Institute (CLSI) para o ano de 2016.15
VARIÁVEIS DE ANÁLISE
Foram analisadas variáveis como setor da coleta, nome do agente isolado, perfil de resistência dos isolados, proporção de hemoculturas positivas conforme o setor, taxa de contaminação das amostras.
DEFINIÇÃO DE CONTAMINAÇÃO DAS AMOSTRAS/MULTIRRESISTÊNCIA DAS AMOSTRAS
O isolamento de três ou mais germes diferentes na hemocultura foi considerado como contaminação da amostra. Outros germes também foram classificados como contaminantes: Corynebacterium spp (excluído C. diphtheriae), Bacillus spp (excluído o B. anthracis), Propionibacterium spp, Streptococcus do grupo viridans, Aerococcus spp e Micrococcus spp.1 O S. coagulase negativo foi classificado como contaminante, caso isolado em amostra única de hemocultura.
A definição de multirresistência obedeceu ao critério estabelecido por Siegel e colaboradores.16
ANÁLISE DE DADOS
Uma análise descritiva foi realizada em relação aos agentes isolados nas hemoculturas e outras variáveis descritas anteriormente. A proporção de contaminação das hemoculturas foi calculada através de porcentagem simples (número de hemoculturas contaminadas/total de hemoculturas coletadas). Utilizamos o teste qui-quadrado para comparar proporções e o teste t de Student para comparação de médias, quando necessário. Um valor de p (< 0,05) foi considerado como estatisticamente significativo.
ASPECTOS ÉTICOS
O projeto foi submetido à Plataforma Brasil e aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal Fluminense, sob o parecer 2.280.097 de 17 de setembro de 2017 e Certificado de Apresentação para Apreciação Ética 69901017.9.0000.5243.
RESULTADOS
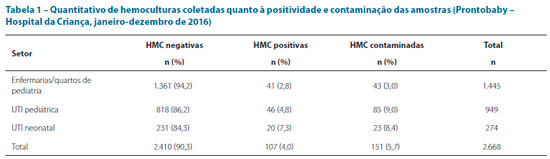
Foram coletadas 2.679 hemoculturas, sendo 11 (0,4%) amostras excluídas por falta de resultados disponíveis. A tabela 1 mostra a positividade de amostras, conforme o setor de internação, e o quantitativo de amostras consideradas como contaminações.
A comparação estatística do percentual de positividade entre os setores mostrou resultados diferentes conforme o local de coleta, sendo (20/274; 7,3%) [IC 95% de 1,7902 a 8,2775, p = 0,0002] na UTI neonatal e (46/949; 4,8%) [IC 95% de 0,4581 a 3,7163, p = 0,0101] na UTI pediátrica, quando comparadas ao encontrado (41/1.445; 2,8%) nas enfermarias de pediatria.
Também foram notadas proporções de contaminação diferentes na UTI pediátrica (85/949; 9%) [IC 95% de 4,0565 a 8,1310, p < 0,001] e UTI neonatal (23/274; 8,4%) [IC 95% de 2,4822 a 9,3612, p < 0,001] quando comparadas às amostras coletadas nas enfermarias de pediatria (43/1.445; 3%).
Em relação aos germes mais comumente isolados nas culturas positivas, foi identificado o Staphylococcus aureus resistente à meticilina (MRSA) como o mais frequente tanto na UTI pediátrica quanto na UTI neonatal, com 12 e 7 isolados, respectivamente. Não foram isolados no período hemoculturas com Acinetobacter spp, enterobactérias resistentes a carbapenêmicos ou enterococos resistentes à vancomicina em nenhum dos setores estudados. Houve somente três isolados (0,1%) de germes produtores de betalactamase de espectro estendido e um isolado (0,04%) de Pseudomonas aeruginosa resistente a carbapenêmicos.
DISCUSSÃO
Um desafio diário para as instituições de saúde que prestam atendimento pediátrico e neonatal é correlacionar adequadamente os resultados encontrados nas hemoculturas com o quadro clínico do paciente. Nesse contexto, faz-se necessário conhecer a epidemiologia das infecções de corrente sanguínea em hospitais pediátricos, de modo a identificar os germes mais prevalentes em cada unidade e, através do conhecimento gerado, instituir medidas necessárias para a redução da taxa de contaminação das amostras.
A positividade de hemoculturas em pediatria, varia bastante conforme o cenário estudado. Em nossa casuística encontramos um valor geral de 4% do total de amostras coletadas. Tais valores são semelhantes aos encontrados por Crichton e colaboradores (2,1%) em coleta de 7.427 hemoculturas, durante três anos de seguimento, em hospital pediátrico na África do Sul.17 Por outro lado, Labi et al. relataram uma positividade de 23,16% em 15.683 hemoculturas coletadas em um hospital de Gana, das quais foram excluídas da análise as realizadas em neonatos.8 Estudo semelhante, realizado uma única instituição pediátrica na Turquia, reportou uma positividade de 29,47% nas 7.040 hemoculturas coletadas.9
A despeito da positividade global ter sido baixa em nossa instituição, encontramos valores significantemente maiores nas unidades críticas como a UTI neonatal e pediátrica quando comparadas às enfermarias de pediatria. Este achado pode ser explicado pelo fato de as crianças internadas nesses setores terem a probabilidade maior de apresentar quadros clínicos de maior gravidade, como sepse, pneumonias graves e bacteremias, que justificariam o encontro desses valores.
No nosso estudo, foi utilizado um método de semiautomação para identificação das amostras, o que também pode ter influenciado nos resultados com menores taxas de positividade. O emprego de sistemas de automação para identificação de positividade de amostras - como o BACTEC® (Becton-Dickinson, EUA), BACT/ALERT® (Biomérieux, França) e similares - permite uma análise inicial do material, com possibilidade de decisão terapêutica que possa guiar o tratamento empírico antimicrobiano em até 12 horas após a coleta de hemoculturas.2 A utilização do sistema BACTEC 9240® para identificação de hemoculturas positivas em pacientes pediátricos com suspeita de sepse encontrou uma positividade de 36% contra 24% dos métodos convencionais em 100 casos suspeitos.18 Em outro estudo realizado em 101 recém-nascidos com suspeita de sepse neonatal, a identificação de patógenos ocorreu em 45,5% dos casos, com a utilização do sistema BACT/ALERT® 3D comparado com 18,8% quando se utilizou o método manual (p < 0,0001).19
Outro tópico bastante debatido na literatura é a conduta a ser tomada quando são identificados germes como o S. coagulase negativo. Em virtude de serem considerados como bactérias contaminantes de pele, a presença de isolado único não permitiria atestar com certeza a causa da infecção.1 No entanto, dificilmente as instituições de saúde conseguem adotar a prática de coletar um número maior de amostras de hemoculturas na suspeita de infecções de corrente sanguínea, ou infecções de foco indeterminado, o que deixa o clínico em uma situação conflitante em relação à tomada de decisão por ocasião do encontro desse germe em amostra única de hemocultura. Em neonatologia, o S. coagulase negativo é agente comum de infecções de corrente sanguínea e no estudo de Labi e colaboradores foi o agente mais frequentemente isolado tanto nos casos de sepse de início precoce (59,1%) quanto nos casos de início tardio (52,8%), de um total de 8.025 hemoculturas coletadas, em um hospital de Gana.8 Em nosso trabalho, optamos por considerar as amostras únicas de S. coagulase negativo como germes contaminantes de pele, conforme o padronizado na literatura mundial.1 Porém, é possível que algum caso isolado, o agente pudesse ser efetivamente causador de infecção de corrente sanguínea e não apenas contaminante.
Encontramos em nosso estudo, uma proporção global de contaminação das amostras de 5,7%, valor maior que os 3% usualmente recomendados como toleráveis para adultos.5,14 Apesar disso, não há ainda definição de quais valores seriam específicos para pediatria e neonatologia e se esses valores variam ou não de acordo com o setor estudado. Por exemplo, Crichton e colaboradores encontraram uma proporção de contaminação de 10,5% em hemoculturas coletadas em um hospital pediátrico com enfermarias, UTI neonatal, enfermaria canguru e leitos de observação em emergência pediátrica.17 Em outro estudo de Murni e cols., realizado na Indonésia para identificar a proporção de contaminação de hemoculturas coletadas em enfermarias pediátricas e UTI pediátrica, encontrou-se um valor de 4,1% nas 1.293 amostras.6
A proporção de contaminação das amostras em nosso trabalho, a exemplo da positividade, também variou conforme o setor, sendo maior estatisticamente nas UTIs pediátrica e neonatal, quando comparadas à taxa encontrada nas enfermarias. Provavelmente os resultados podem ser atribuídos à maior dificuldade técnica na realização dos exames nos pacientes críticos, o que poderia contribuir para o percentual mais alto nessas taxas.
Uma limitação de nosso trabalho foi ter realizado o estudo em instituição única, o que representa um perfil epidemiológico local. No entanto, o hospital de estudo é, atualmente, o maior hospital exclusivamente pediátrico do estado do Rio de Janeiro e recebe pacientes de diferentes instituições de saúde, não só da região metropolitana mas também de outras regiões do estado, o que pode representar realidade semelhante de outros hospitais.
A despeito do MRSA ter sido isolado como o germe mais frequente tanto na UTI pediátrica quanto na UTI neonatal, não detectamos positividade para germes considerados como críticos pela Organização Mundial da Saúde para pesquisa e desenvolvimento de novos antibióticos, como Acinetobacter baumannii e enterobactérias resistentes a carbapenêmicos.20 Tal fato deve-se provavelmente à existência de um programa de controle de infecção hospitalar desde o ano 2000 e à adoção de um programa formal de gestão de antimicrobianos, em curso na instituição desde 2016.
CONCLUSÕES
Concluímos que a positividade das hemoculturas foi baixa, sendo verificada maior taxa de amostras positivas nas unidades críticas como UTI pediátrica e UTI neonatal, setores nos quais também foram verificadas maiores taxas de contaminação. Futuros estudos, correlacionando a positividade das amostras de hemoculturas com o quadro clínico do paciente e incluindo vários centros, poderão contribuir para estabelecer melhor o perfil epidemiológico das infecções de corrente sanguínea não só no Rio de Janeiro como também em todo o país, com ênfase na frequência de germes multirresistentes encontrados nas amostras positivas de hemoculturas.
REFERÊNCIAS
1. Brasil. Agência Nacional de Vigilância Sanitária. Critérios nacionais de infecções relacionadas à assistência à saúde. Série: Segurança do paciente e qualidade em serviços de saúde. Brasília: Anvisa; 2017 [acesso em 19 set 2018]. Disponível em: http://portal.anvisa.gov.br/documents/33852/3507912/Caderno+2+-+Crit%C3%A9rios+Diagn%C3%B3sticos+de+Infec%C3%A7%C3%A3o+Relacionada+%C3%A0+Assist%C3%AAncia+%C3%A0+Sa%C3%BAde/7485b45a-074f-4b34-8868-61f1e5724501
2. De SK, Shetty N, Kelsey M. How to use... blood cultures. Arch Dis Child Educ Pract Ed. 2014;99(4):144-51.
3. Venturini E, Montagnani C, Benni A, Biermann KP, De Masi S, Chiappini E et al. Central-line associated bloodstream infections in a tertiary care children's University hospital: a prospective study. BMC Infect Dis. 2016;16(1):725.
4. Ozsurekci Y, Aykac K, Cengiz AB, Basaranoglu ST, Sancak B, Karahan S et al. Bloodstream infections in children caused by carbapenem-resistant versus carbapenem-susceptible Gram-negative microorganisms: risk factors and outcome. Diagn Microbiol Infect Dis. 2017;87(4):359-64.
5. Robertson P, Russell A, Inverarity DJ. The effect of a quality improvement programme reducing blood culture contamination on the detection of bloodstream infection in an emergency department. J Infect Prev. 2015;16(2):82-7.
6. Murni IK, Duke T, Daley AJ, Kinney S, Soenarto Y. True pathogen or contamination: validation of blood cultures for the diagnosis of nosocomial infections in a developing country. J Trop Pediatr. 2017. DOI: https://doi.org/10.1093/tropej/fmx081
7. Hitzenbichler F, Simon M, Salzberger B, Hanses F. Clinical significance of coagulase-negative staphylococci other than S. epidermidis blood stream isolates at a tertiary care hospital. Infection. 2017;45(2):179-86.
8. Labi AK, Obeng-Nkrumah N, Bjerrum S, Enweronu-Laryea C, Newman MJ. Neonatal bloodstream infections in a Ghanaian Tertiary Hospital: are the current antibiotic recommendations adequate? BMC Infect Dis. 2016;16:598. DOI: https://doi.org/10.1186/s12879-016-1913-4
9. Yiş R. Evaluation of blood cultures in a children's hospital located in Southeastern Anatolia. Turk Pediatri Ars. 2015;50(2):102-7.
10. Almahadi YM, Aldeyab MA, McEnlay, Scott MG, Darwish Elhajji FW, Magee FA et al. Clinical and economic impact of contaminated blood cultures within the hospital setting. J Hosp Infect. 2011;77(3):233-6.
11. Bates DW, Goldman L, Lee TH. Contaminant blood cultures and resource utilization: the true consequences of false-positive results. JAMA. 1991;265(3):365-9.
12. Hossain B, Weber MW, Hamer DH, Hibberd PL, Ahmed AS, Marzan M et al. Classification of blood culture isolates into contaminants and pathogens on the basis of clinical and laboratory data. Pediatr Infect Dis J. 2016;35(5):S52-4.
13. O'Connor C, Philip RK, Powell J, Slevin B, Quinn C, Power L et al. Combined education and skin antisepsis intervention for persistently high blood-culture contamination rates in neonatal intensive care. J Hosp Infect. 2016;93(1):105-7.
14. Schifman RB, Strand CL, Meier FA, Howanitz PJ. Blood culture contamination: a College of American Pathologists Q-Probes study involving 640 institutions and 497134 specimens from adult patients. Arch Pathol Lab Med. 1998;122(3):216-21.
15. Clinical and Laboratory Standards Institute. M100S: performance standards for antimicrobial susceptibility testing. 26th ed. 2016 [access on Set 19, 2018]. Available from: http://ljzx.cqrmhospital.com/upfiles/201601/20160112155335884.pdf
16. Siegel JD, Rhinehart E, Jackson M, Chiarello L; Healthcare Infection Control Practices Advisory Committee. Management of multidrug-resistant organisms in healthcare settings, 2006. Am J Infect Control. 2007;35(10 Suppl 2):S165-93.
17. Crichton H, O'Connell N, Rabie H, Whitelaw A, Dramowski A. Neonatal and paediatric bloodstream infections: pathogens, antimicrobial resistance patterns and prescribing practice at Khayelitsha District Hospital, Cape Town, South Africa. S Afr Med J. 2018;108(2):99-104.
18. Ahmad A, Iram S, Hussain S, Yusuf NW. Diagnosis of paediatric sepsis by automated blood culture system and conventional blood culture. J Pak Med Assoc. 2017;67(2):192-5.
19. Hasan AS, Uppal P, Arya S, Capoor MR, Nair D, Chellani H et al. Comparison of BacT/Alert microbial detection system with conventional blood culture method in neonatal sepsis. J Pediatric Infect Dis Soc. 2008;3(1):21-5.
20. World Health Organization. WHO publishes list of bacteria for which new antibiotics are urgently needed. Geneve, 2017 [access on Mai 9, 2018]. Available from: http://www.who.int/en/news-room/detail/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed