Número atual: 24(1) - Março 2024
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Relato de Caso
Sucesso de tratamento da tuberculose multirresistente em lactente
Multidrug-resistant tuberculosis successful treatment in an infant
Sheila Cunha Lucena1; Regina Gayoso Coutinho2; Margareth Pretti Dalcolmo3
DOI:10.31365/issn.2595-1769.v24i1p17-21
1. Hospital Raphael de Paula Souza, Ambulatório - Rio de Janeiro - Rio de Janeiro - Brasil
2. UERJ, IMS - Rio de Janeiro - Rio de Janeiro - Brasil
3. FIOCRUZ/ENSP, Centro de Referência Hélio Fraga - Rio de Janeiro - Rio de Janeiro - Brasil
Endereço para correspondência:
Sheila Cunha Lucena carolinamantovani@gmail.com
Instituição: Hospital Raphael de Paula Souza, Rio de Janeiro
Recebido em: 21/12/2021
Aprovado em: 17/12/2023
Resumo
Apresentamos um caso de tuberculose multirresistente (TBMDR) em lactente, internado com diagnóstico inicial de pneumonia, sem melhora após uso de antibióticos. O lavado gástrico mostrou baciloscopia e cultura positivas (+). Mãe tabagista, sintomática respiratória, radiografia do tórax com imagem bilateral cavitária e baciloscopia positiva (+++). O resultado da cultura de ambas foi positiva para Mycobacterium tuberculosis (Mtb) e o teste de sensibilidade apresentou o mesmo padrão de multirresistência. A criança fez esquema de tratamento composto de capreomicina, etambutol, levofloxacina, terizidona e pirazinamida, com ótima resposta, evoluindo para a cura após 15 meses de tratamento. É extremamente importante buscar o diagnóstico precoce da enfermidade, a história de contato e a pronta instituição do esquema terapêutico para o sucesso do tratamento da TBMDR em crianças.
Palavras-chave: Tuberculose Resistente a Múltiplos Medicamentos. Tratamento Farmacológico. Lactente.
Abstract
We report a case of multidrug-resistant tuberculosis (MDR-TB) in a six-month infant having an initial diagnosis of pneumonia without improvement after antibiotic use. The gastric aspirate sample showed smear microscopy and culture positives. Her mother had respiratory symptomatology, positive smear (+++), bilateral cavities on chest x-ray, and a smoking habit. The child and her mother had culture positive for Mycobacterium tuberculosis (Mtb) and both sensitivity tests presented the same pattern of multidrug-resistance. Treatment regimen was composed of capreomycin, ethambutol, levofloxacin, terizidon and pyrazinamide. The child had an excellent response, evolving to a cure after 15 months of treatment. It is extremely important to seek early diagnosis, the history of close contact, and prompt establishment of the therapeutic regimen for the successful treatment of MDR-TB in children.
Keywords: Tuberculosis. Multidrug-Resistant. Treatment Outcome. Infant.
1. Introdução
A tuberculose multirresistente (TBMDR) é causada pelo Mycobacterium tuberculosis (Mtb) resistente a rifampicina e isoniazida, os principais fármacos antituberculose de primeira linha.1 Em 2022, a Organização Mundial da Saúde (OMS) estimou o número de casos globais de tuberculose (TB) em 10,6 milhões, sendo 12% em menores de 15 anos.2 Os casos estimados de TBMDR foram 410.000.2 No Brasil, 4% dos 87.344 casos de TB notificados em 2022 ocorreram em menores de 15 anos.2
O número de crianças com TBMDR no mundo ainda não está bem estabelecido.3 Globalmente, só 5% dos casos de TBMDR pediátricos seriam identificados por ano, e poucos receberiam tratamento adequado.4 De 2015 a 2020 foram notificados, no Brasil, 18 casos de TBMDR com idade até 14 anos.5
A doença pediátrica está associada com a alta mortalidade. Com o aumento do número de casos de TBMDR no mundo, houve também aumento de crianças expostas, sendo consideradas de maior risco as menores de um ano de idade.6 Invariavelmente indicam fonte de contato domiciliar, e, por conseguinte, a criança em geral adquire a TBMDR primária, e poucas têm resistência adquirida.6
Após a infecção tuberculosa, 90% das crianças que vão desenvolver a doença o fazem no primeiro ano após o contato com o caso índice, e praticamente a totalidade destas fica doente no intervalo de dois anos.3,6 Lactentes e crianças pequenas têm risco maior de desenvolver a doença após infecção tuberculosa, que diminui com o passar dos anos, sendo semelhante ao risco do adulto após cinco anos de idade.6 Poucas são diagnosticadas e tratadas adequadamente, devido à dificuldade de confirmação do diagnóstico.7 Os possíveis motivos para baixa detecção incluem a natureza paucibacilar e as dificuldades de se obter amostras para confirmação do diagnóstico.3
A apresentação clínica e radiológica de TBMDR na criança é semelhante à da TB sensível.3 É extremamente importante a história de contato com caso de TB. Na suspeita de TBMDR em crianças, convém obter amostras de escarro ou outro material biológico para confirmação por testes moleculares, que permitem detectar rapidamente o bacilo rifampicina resistente, e realizar cultura e teste de sensibilidade (TS) ampliado. Se a criança tem história prévia de contato com uma pessoa doente sem melhora, ou não aderente ao tratamento, é fundamental a informação se é caso de TBMDR com o padrão de resistência.6 A TBMDR deve ser considerada nas crianças com diagnóstico de TB sem identificação do caso índice e que apesar da adesão não apresentam melhora.3 O diagnóstico e o tratamento precoces podem evitar a progressão para formas mais graves da doença.7 A escolha do regime terapêutico na criança segue os mesmos princípios usados para o tratamento do adulto.8 O tratamento é um desafio, envolve o uso de fármacos com elevada toxicidade, formulações existentes no país ainda inadequadas para utilização na criança e um longo período de duração.9 Porém, os benefícios podem superar os riscos se o responsável for orientado sobre a importância da adesão ao tratamento.7 Atualmente, a OMS recomenda o uso de regimes de curta duração (9-11 meses) para TBMDR não complicada, com medicamentos orais, inclusive para crianças.8 Os esquemas utilizariam combinações de medicamentos novos como bedaquilina, delamanida e fluoroquinolonas, entre outros.7,8 Vários medicamentos já existem em formulações palatáveis para crianças, disponíveis para aquisição através de instituições como a Global Drug Facility.10
Consultas e exames devem ser realizados regularmente para detectar precocemente sinais de falha ou reação adversa. Estudos recentes mostram que mais de 80% das crianças com TBMDR podem ser tratadas com sucesso.3 O Brasil segue a proposta da OMS no que diz respeito às prioridades relacionadas à detecção precoce dos casos e tratamento do paciente.1
2. Relato do caso
Lactente com seis meses de idade, sexo feminino, encaminhada de outro hospital para tratamento de TBMDR. Relato de febre, adenomegalia cervical bilateral há um mês e radiografia do tórax (RX) com consolidação homogênea em lobo superior esquerdo (LSE). Ultrassonografia do abdômen evidenciou incontáveis linfonodos no retroperitôneo e ausência de hepatoesplenomegalia. Utilizados antibióticos por 10 dias sem melhora radiológica. O lavado gástrico mostrou baciloscopia positiva, sendo iniciado esquema padronizado para TB (rifampicina, isoniazida, pirazinamida) associado à prednisolona. Evoluiu com persistência da febre, estado geral mantido.
Mãe com relato de tratamento prévio para TB pulmonar, com desfecho de cura. Recidiva após um ano, pouca adesão ao tratamento. Apresentava-se sintomática respiratória, RX com cavidades bilaterais, baciloscopia positiva (+++), pedido cultura e TS. Reiniciado esquema básico com dose fixa combinada. Relata ter feito pré-natal, não soube precisar número de consultas. Tabagista, etilista, com baixo nível de escolaridade.
A criança nasceu de parto hospitalar, boas condições de vitalidade. Aleitamento materno nos três primeiros meses, desenvolvimento normal para idade. Contatos avaliados, porém sem acompanhamento regular. Ao exame físico, estava ativa, febril, hidratada, hipocorada +/4+, acianótica, anictérica. Linfonodos cervicais bilaterais, indolores, móveis sem sinais flogísticos, medindo 1,5cm de maior diâmetro. Cicatriz de BCG presente. Taquipneia leve, SaO2=97%, diminuição do murmúrio vesicular no hemitórax esquerdo, sopro tubário no terço superior. Ritmo cardíaco normal. Ausência de hepatoesplenomegalia. Desenvolvimento compatível com a faixa etária, ausência de comprometimento neurológico. Peso: 8 kg (Percentil: 50-85), estatura: 63 cm (Percentil: 3-15).11
Exames complementares: hemograma mostrou anemia, Hb:10,6g/dl, leucócitos 11.600, 03 bastões, PCR: 15,0 mg/L (VR: 5mg/L). TGO/AST: 60,0U/L (VR: 9-80 U/L), TGP/ALT: 8U/L (VR:13-45U/L), anti-HIV negativo. Líquor normal, com cultura negativa para germes comuns e micobactérias. Tomografia de crânio normal. Fundoscopia normal. Lavado gástrico: baciloscopia positiva, cultura: Mycobacterium tuberculosis. TS da criança mostrou resistência a rifampicina, isoniazida, estreptomicina e sensível ao etambutol, padrão igual ao materno. Ecocardiograma normal. Radiografia do tórax apresentando opacidade homogênea no LSE (Figura 1). Nova ultrassonografia: sem evidência de linfonodomegalias no retroperitôneo e ausência de hepatoesplenomegalia.
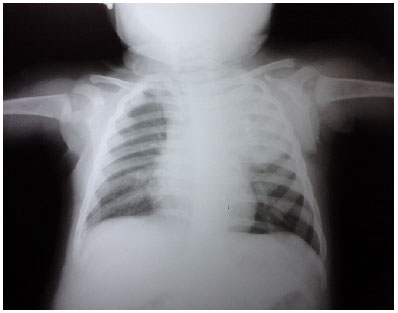
Figura 1. Radiografia de tórax AP - consolidação em LSE.
Iniciado esquema com capreomicina (15mg/kg/dia), etambutol (20mg/kg/dia), levofloxacino (10mg/kg/dia), terizidona (15mg/kg/dia), pirazinamida (35mg/kg/dia) e piridoxina 25mg/dia, segundo preconizado pelo Ministério da Saúde (MS).1 Evoluiu com desaparecimento da febre após 30 dias de tratamento, ganho ponderal e sem apresentar efeitos adversos. Lavado gástrico no 1º mês com baciloscopia negativa e cultura positiva. Alta após 42 dias de internação, com recomendação para tratamento diretamente observado (TDO).
Feito acompanhamento clínico mensal, com internações para lavado gástrico no 2º, 4º, 6º e 11º meses de tratamento. Baciloscopias e culturas negativas. Emissão otoacústica normal no segundo mês. Tomografia computadorizada de tórax no 7º mês: redução volumétrica do LSE, cavidade de parede espessada com calcificação de permeio na porção posterior do segmento ápico-posterior e faixas fibroatelectásicas (Figura 2).
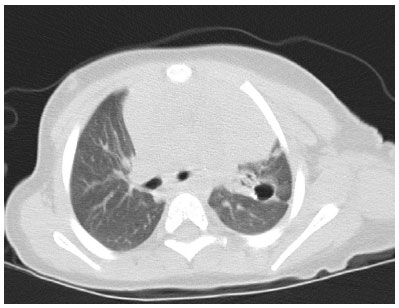
Figura 2. Sétimo mês de tratamento, tomografia mostrando lesão cavitária com calcificação em LSE.
A capreomicina foi descontinuada a partir do 5º mês, e pirazinamida a partir do 7º mês. A duração total do tratamento foi de 15 meses. O regime de TDO e monitoramento radiológico comprovaram a adesão, ausência de efeitos adversos e excelente resposta ao tratamento. Radiografia de acompanhamento mostrou fibrose e calcificação no LSE (Figura 3). Mãe e filha receberam alta curadas, continuando acompanhamento ambulatorial.
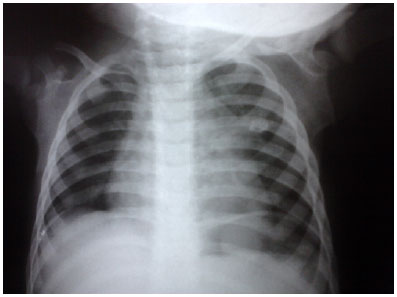
Figura 3. Lesão calcificada em LSE.
O relato do caso foi aprovado pelo CEP sob o nº CAAE92131118.7.0000.5240.
3. Discussão
A maioria dos lactentes adquire TB através de contato próximo, geralmente intradomiciliar, como no caso descrito, em que a mãe foi o caso-índice.6 O risco de progressão de infecção para doença está relacionado a idade, resposta imune, desnutrição e imunodeficiência. Lactentes infectados têm maior risco de progressão para doença e desenvolver forma disseminada. No caso descrito, destaca-se a importância de manter alto índice de suspeita de TB no lactente que apresenta febre, adenomegalia cervical e imagem radiológica de consolidação pulmonar, que não melhora com antibióticos. A mãe apresentava tosse, sendo solicitada apenas uma amostra de escarro no final da gestação e após parto, sem ter sido valorizada a história prévia de TB com falha no tratamento. Sempre que possível, buscar confirmação diagnóstica com culturas e testes moleculares. A coleta de amostras do lavado gástrico confirmou cultura positiva para M. tuberculosis, e o TS do lactente mostrou o mesmo padrão de multirresistência da mãe. Não conseguindo obter o padrão de resistência da criança, guiar o tratamento pelo TS do caso índice.
A grande dificuldade foi a inexistência de medicamentos com formulação adequada para lactentes. Os medicamentos foram preparados em farmácia de manipulação, e as doses reajustadas de acordo com peso, quando necessário. Só recentemente, o Brasil incorporou o uso de comprimidos de dose fixa combinada dispersíveis para tratamento da TB sensível em crianças.12 Formulações adequadas para o tratamento das formas resistentes em crianças ainda não estão disponíveis em nosso país.10
A duração do tratamento da TBMDR em crianças depende da apresentação e gravidade da doença. Crianças com doença não severa podem ser tratadas por 9 a 12 meses, enquanto as que apresentam doença severa, de 12 a 18 meses, dependendo da evolução clínica.7 A OMS define doença grave em crianças menores de 15 anos na presença de lesões cavitárias ou acometimento bilateral, e formas extrapulmonares outras que não linfoadenopatia. Desnutrição severa, imunossupressão avançada e bacteriologia positiva podem ser consideradas quanto à duração do tratamento.8
Bedaquilina e delamanida já podem ser utilizadas em crianças de qualquer idade na composição dos esquemas de tratamento.7,8 Esses novos medicamentos foram incorporados pelo SUS em 2020, havendo atualização dos esquemas de tratamento para TBMDR em adultos.13
REFERÊNCIAS
1. Ministério da saúde (BR) SVS. Manual de Recomendações para o Controle da Tuberculose no Brasil. 2a Edição. Brasília: Ministério da Saúde, https://bvsms.saude.gov.br/bvs/publicacoes/manual_recomendacoes_controle_tuberculose_brasil_2_ed.pdf. (2019)
2. WHO-World Health Organization. Global tuberculosis report 2023. World Health Organization, https://www.who.int/publications-detail-redirect/9789240083851 (2023).
3. Schaaf HS, Garcia-Prats AJ. Multidrug-Resistant Tuberculosis in Children: Recent Developments in Diagnosis, Treatment and Prevention. Curr Pediatr Rep. 2016; 4: 53–62.
4. Huynh J, Marais BJ. Multidrug-resistant tuberculosis infection and disease in children: a review of new and repurposed drugs. Ther Adv Infect Dis. 2019; 6: 2049936119864737.
5. BRASIL-Ministério da Saúde. Sistema de Registro de Tratamentos Especiais de Tuberculose (SITETB) - http://sitetb.saude.gov.br (2023).
6. Seddon JA, Johnson S, Palmer M, van der Zalm MM, Lopez-Varela E, Hughes J, Schaaf HS. Multidrug-resistant tuberculosis in children and adolescents: current strategies for prevention and treatment. Expert Rev Respir Med. 2021; 15: 221–237.
7. The Sentinel Project for Pediatric Drug-Resistant Tuberculosis. Management of Drug-Resistant Tuberculosis in Children: A Field Guide. 5a Edição. Boston, USA, https://sentinel-project.org/wp-content/uploads/2022/04/DRTB-Field-Guide-2021_v5.1.pdf (2022).
8. World Health Organization. WHO consolidated guidelines on tuberculosis. Module 5: management of tuberculosis in children and adolescents. Genebra: World Health Organization, https://iris.who.int/bitstream/handle/10665/352522/9789240046764-eng.pdf?sequence=1 (2022).
9. Taneja R, Garcia-Prats AJ, Furin J, Maheshwari HK. Paediatric formulations of second-line anti-tuberculosis medications: challenges and considerations. Int J Tuberc Lung Dis. 2015; 19: 61–68. doi: 10.5588/ijtld.15.0435. PMID: 26564545.
10. Global Drug Facility. September 2023 Medicines Catalog. Genebra: Stop TB Partnership, 2023.
11. WHO-World Health Organization. The WHO Child Growth Standards, http://www.who.int/childgrowth/standards/ (2023).
12. Ministério da Saúde (BR) Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. PORTARIA No 43, DE 6 DE SETEMBRO DE 2019, https://www.in.gov.br/web/dou/-/portaria-n-43-de-6-de-setembro-de-2019-215084454 (2019).
13. Ministério da Saúde (BR) SVS. NOTA INFORMATIVA No 9/2021, https://www.gov.br/aids/pt-br/central-de-conteudo/notas-informativas/2021/nota-informativa-no-9-2021-cgdr-dcci-svs-ms/view (2021).






