Número atual: 17(supl 1)(1) - 2017
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigos de Revisao
Hemorragia digestiva em crianças: uma visão geral
Gastrointestinal bleeding in children: an overview
Cláudio Tortori
Professor-Associado de Pediatria na Escola de Medicina Geral da Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro
Endereço para correspondência:
Recebido em: 13/9/2017 Aprovado em: 20/9/2017 Instituiçao: Universidade Federal do Estado do Rio de Janeiro
Resumo
INTRODUÇÃO: o sangramento digestivo ainda representa um problema importante na gastroenterologia geral e pediátrica, apesar dos diversos recursos tecnológicos de imagem e endoscópicos que surgiram nas últimas décadas.
OBJETIVO: rever causas, medidas e procedimentos terapêuticos gerais de importância para conduzir um paciente pediátrico com sangramento digestivo.
FONTE DE DADOS: foram revisadas as principais publicações sobre o tema hemorragia digestiva na faixa etária pediátrica, incluindo dados epidemiológicos nacionais de morbidade dos últimos seis anos de doenças que podem cursar com o quadro referido, considerando principalmente etiologia, manifestações clínicas, exames gerais e específicos além de aspectos relacionados à conduta no paciente tanto do ponto de vista geral de estabilização nos quadros graves, quanto específicas de medicamentos e estratégias visando o diagnóstico e tratamento das crianças acometidas.
SÍNTESE DOS DADOS: de acordo com a idade de acometimento, alterações do exame clínico e provas laboratoriais mais simples, é possível diagnosticar um grande número de episódios e orientar medidas terapêuticas iniciais visando diminuir a hemorragia até que exames mais complexos sejam realizados.
CONCLUSÕES: medidas gerais clínicas e terapêuticas devem ser instituídas, e o monitoramento adequado do paciente após um episódio de hemorragia digestiva na criança é importante no diagnóstico e acompanhamento de todos os casos.
Palavras-chave: Hemorragia gastrointestinal; Hemorragia; Trato gastrointestinal; Criança; Lactente; Recém-nascido.
Abstract
INTRODUCTION: gastrointestinal bleeding still represents a major problem in general and pediatric gastroenterology, despite many technological imaging and endoscopic features that have emerged in recent decades.
OBJECTIVE: to review causes and general therapeutic procedures of importance to conduct a pediatric patient with gastrointestinal bleeding.
DATA SOURCE: we reviewed the main publications on the subject of digestive hemorrhage in the pediatric age group, including national epidemiological data on the morbidity of the last 6 years of diseases that may occur with the aforementioned condition, mainly considering the etiology, clinical manifestations, general and specific examinations as well as aspects related to the patient's conduct both from the general point of view of stabilization in the severe, and specific cases of medications and strategies aimed at the diagnosis and treatment of the children affected.
DATA SYNTHESIS: depending on the age of the patient, changes in the clinical examination and common laboratory tests, it is possible to diagnose a large number of episodes and guide initial therapeutic procedures in order to reduce hemorrhage until more complex tests are performed.
CONCLUSIONS: general clinical and therapeutic strategies should be instituted and proper monitoring of the patient following an episode of gastrointestinal bleeding in the child is important in the diagnosis and follow-up of all cases.
Keywords: Gastrointestinal hemorrhage; Hemorrhage; Gastrointestinal tract; Child; Infant; Infant, newborn.
INTRODUÇÃO
O sangramento digestivo, a despeito dos diversos recursos tecnológicos de imagem e endoscópicos que surgiram nas últimas décadas, ainda representa um problema importante na gastroenterologia geral e pediátrica. Pode acompanhar uma série de doenças digestivas e ocorrer de forma súbita ou insidiosa. O sangramento digestivo pode ser oculto ou claramente acompanhado de perda visível (via hematêmese, melena, ou enterorragia) e é chamado obscuro quando, em adultos, não se detecta a causa mesmo após endoscopia digestiva alta, colonoscopia e exame radiológico para avaliação do intestino delgado.1 É importante que um sangramento digestivo tenha a sua ocorrência confirmada e a análise dos fatores relacionados à ocorrência deste episódio, visto que a topografia e a faixa etária envolvida podem sugerir a etiologia do quadro.
De forma geral, a hemorragia digestiva pode ser classificada como alta, quando a origem está localizada até o ângulo de Treitz (que se localiza na junção entre o duodeno e jejuno), ou baixa, quando a origem se encontra após este. A hemorragia digestiva alta (HDA) geralmente se associa à hematêmese, que é a eliminação de sangue através do vômito com aspecto de borra de café, ou mesmo com aspecto de sangue vivo quando o sangramento é volumoso. Também pode ocorrer associada à melena, que é a eliminação de fezes com sangue digerido e aspecto viscoso, enegrecido, semelhante a piche e com odor bastante fétido. A melena ocorre na imensa maioria das vezes secundária ao sangramento proveniente do trato gastrintestinal superior, mas pode ocorrer com origem no intestino delgado ou colón proximal.2
A incidência da hemorragia digestiva em crianças não está bem-definida, pois não existem estudos epidemiológicos multicêntricos. Nos EUA, a incidência de sangramento por úlcera péptica em crianças aumentou de 0,5 a 0,9 para 4,4 por 100.000 entre 2004 e 2008.3 Na França, em estudo transversal em 2010, estimou-se em um a dois episódios de HDA para cada 10.000 crianças, com uma proporção de 1,2 meninas para cada menino. Foi identificado o uso de anti-inflamatórios não esteroides (Aines) em 36% dos pacientes e em 77% dos episódios de hemorragia digestiva foi indicada a internação.4
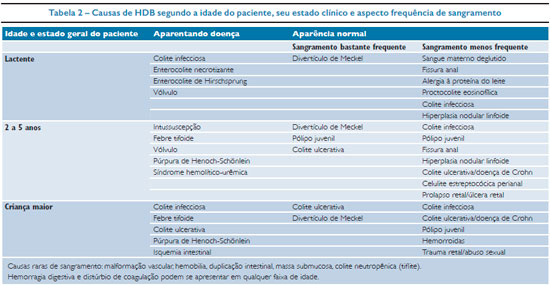
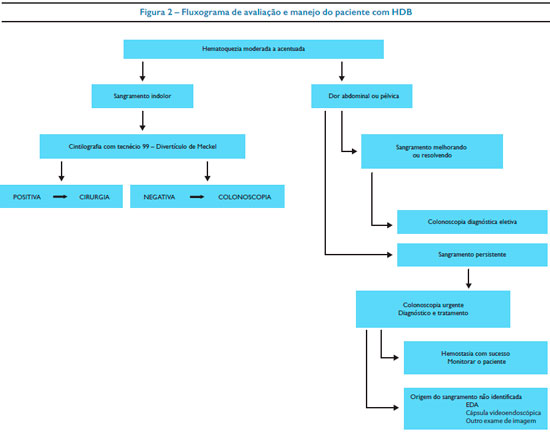
A hemorragia digestiva baixa (HDB) geralmente tem menor gravidade, é menos intensa e frequente que a alta. Na maioria das vezes ocorre como consequência de colites e pólipos e leva a sangramento de pequena intensidade, a não ser quando secundária a divertículo de Meckel, que pode cursar com hemorragia e levar a uma gravidade mais elevada.5,6
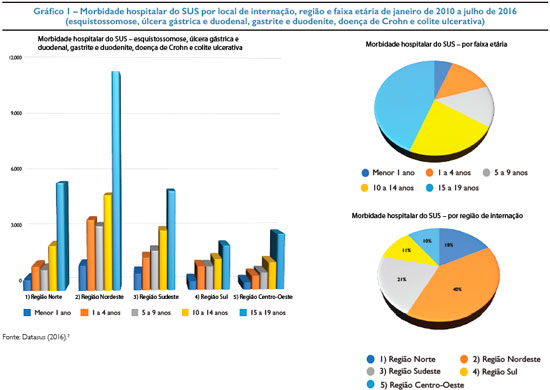
No Brasil, de acordo com os dados do Departamento de Informática do Sistema Único de Saúde do Brasil (Datasus), de morbidade hospitalar de janeiro de 2010 até junho de 2016, das principais doenças que podem cursar com hemorragia digestiva (esquistossomose, úlcera gástrica e duodenal, gastrite e duodenite, doença de Crohn e colite ulcerativa), observamos maior prevalência na Região Nordeste (39,7%), seguida de Sudeste (21,4%), Norte (17,6%) e com as menores prevalências nas regiões Centro-Oeste (10,8%) e Sul (10,5%). Com relação às faixas etárias de acometimento, existe um aumento do percentual de acordo com a progressão da idade: menor de 1 ano (6%), de 1 a 4 anos (13%), 5 a 9 (14%), 10 a 14 (22%) e de 15 a 19 o maior percentual alcançando: 45%. Os dados são apresentados no gráfico 1.7
MÉTODO
Foram analisadas as principais referências bibliográficas nos últimos dez anos com enfoque em estudos de revisão sobre o tema, incluindo o Medline e estatísticas nacionais do Datasus de doenças que podem cursar com hemorragia digestiva. O objetivo principal foi reunir informações para o pediatra-geral sobre a epidemiologia do problema no Brasil e, além disso, dados clínicos de importância para o diagnóstico e conduta nos casos de hemorragia digestiva alta e baixa, que possam auxiliar no atendimento pelo pediatra-geral, visando facilitar o atendimento do especialista.
RESULTADOS
As referências encontradas, dentro do proposto, foram apresentadas de forma a levar o raciocínio como se um paciente se apresentasse para uma consulta com a queixa de hemorragia digestiva. Dados demográficos de faixa etária, bem como de alterações clínicas correlacionadas à faixa etária e ao tipo de alteração, sugerem uma topografia e consequentemente uma etiologia. A seguir são apresentados resultados de estudos que envolvem o risco de uma criança apresentar HDA ou HDB, posteriormente exames gerais de laboratório, endoscópicos, contrastados e finalizando com conduta geral e em situações de gravidade máxima e fluxogramas em ambas as situações de sangramento alto e baixo.
ETIOLOGIA
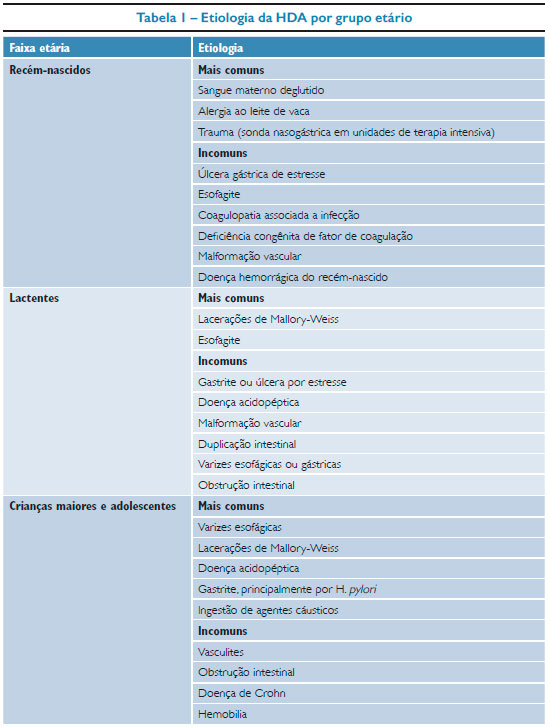
De forma mais sintética, a etiologia da HDA varia de acordo com a faixa etária, conforme proposto por Chawla e colaboradores.8 Na tabela 1 estão dispostas as causas mais comuns e as menos comuns para cada faixa de idade.
Em avaliação de crianças atendidas em setor de emergência pediátrica, foi verificada a incidência de HDB em 0,3% de mais de 40.000 atendimentos em 1994 em Massachusetts.9 Os pólipos gastrointestinais são causas comuns, principalmente nas crianças entre 2 e 5 anos de idade com sangramento indolor, como manifestação mais frequente em geral restrito ao cólon como lesão única do tipo pólipo juvenil. Nas crianças acima de 10 anos, os pólipos podem fazer parte de síndromes com poliposes e os pólipos adenomatosos são mais frequentes.6 O sangramento digestivo baixo, de acordo com a faixa etária e a gravidade do quadro é descrito na tabela 2.
MANIFESTAÇÕES CLÍNICAS ASSOCIADAS
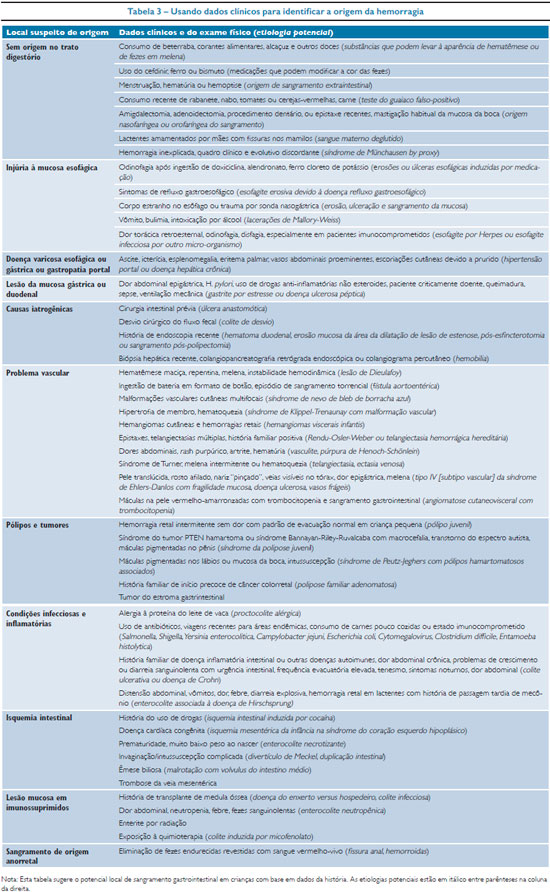
A hemorragia digestiva se associa a manifestações clínicas que têm importância diagnóstica e também podem servir de alerta para o local e a gravidade do volume da perda. Atenção especial aos alimentos em uso pela criança, ocorrência de dor com sua caracterização e forma de apresentação, aspecto das fezes, antecedentes pessoais e sinais clínicos de associação com outras doenças ou síndromes, são extremamente valiosos na suspeição do local e orientação propedêutica. Na tabela 3 estão relacionados dados da história e exame físico que sinalizam para a origem da perda.10
SITUAÇÃO DE RISCO
O risco de uma criança apresentar sangramento digestivo alto durante um episódio de doença infecciosa foi estimado em 7,2 por 100.000. O estudo que estabeleceu esta incidência envolveu 84.192 crianças, mostrou uma incidência baixa, e não mostrou diferença entre pacientes em uso de acetaminofen 12 mg/kg, ou ibuprofeno em grupos que usaram 5 e 10 mg/kg separadamente, mas não foi avaliado o uso prolongado ou crônico dessas drogas.11 Contudo, outros estudos avaliaram o uso de Aines e a ocorrência de HDA. Um na França avaliou um grupo de 177 crianças, entre 2 meses e 16 anos de idade, analisou o uso prévio de Aines e calculou uma razão de chance de 8,2 (95% CI 2,6-26,0) para o uso geral de Aines (pelo menos uma vez nos sete dias que antecederam a hospitalização), 10,0 (95% CI 2,0-51,0) para o ibuprofeno e 7,3 (95% CI 0,9-59,4) para a aspirina.12
Em outro estudo, na Espanha, demonstrou-se que entre 2004 e 2009 de um total de 78 crianças, que internaram com suspeita de HDA, com idade entre 21 meses e 5 anos e 10 meses, nove delas tinham usado entre duas e quatro doses de ibuprofeno, sem uso concomitante de antibiótico ou qualquer outra medicação como corticoide, e apresentaram erosões e úlceras na mucosa gástrica.13
A infecção pelo Helicobacter pylori se associa à gastrite e à doença ulcerosa péptica na infância, contudo é muito menos frequente do que nos adultos. A gastrite antral é a forma mais frequente de manifestação da infecção pelo H. pylori na infância.14 A infecção pelo H. pylori em crianças tem sido encontrada em até 49% (41 a 84) de crianças com HDA.15
Outras situações de risco de HDA estão relacionadas com o paciente crítico em unidades de terapia intensiva (UTI) pediátrica, conforme foi mostrado em trabalho desenvolvido no Tennessee, por um período de quatro meses. Todos os pacientes abaixo de 19 anos foram investigados por meio da ocorrência de eliminação de sangue vivo ou em borra de café pela sonda nasogástrica ou pela ocorrência de melena. De um total de 208 pacientes, 25% apresentaram sangramento digestivo alto, sem diferença de idade, sexo, peso ou raça. Os quadros associados ao risco aumentado da ocorrência de HDA foram choque circulatório, procedimento cirúrgico com duração maior ou igual a três horas e trauma. O uso de antagonistas dos receptores H2 e antiácidos foi suficiente para conter a progressão do sangramento nestes pacientes.16
Também em outro estudo, realizado na Espanha, foram acompanhadas 140 crianças com problemas críticos em UTI, divididas em quatro grupos cujo primeiro nada recebeu, e os outros três receberam almagato ou sucralfato (via sonda gástrica), ou ainda ranitidina intravenosa. O grupo sem tratamento apresentou HDA em 20% dos pacientes; nos outros em 5,7%, com p menor que 0,01 (almagato 5,7%, ranitidina 8,5% e sucralfate 2,8%, sem diferença entre si).17
A ventilação mecânica também é um fator de risco importante para a ocorrência de HDA, como demonstrado em levantamento de UTI pediátrica, no qual durante 12 meses foram avaliadas crianças de um total de 110 admitidas em 2005, sendo selecionadas as que permaneciam em ventilação mecânica por pelo menos 48 horas. Este estudo mostrou uma incidência de 51,7% (57 de 110) de HDA, detectada por meio de resíduo nasogástrico com aspecto de borra de café, hematêmese, hematoquezia ou os dois últimos associadamente. Do total de crianças com sangramento digestivo, 3,6% (4 de 110) apresentaram sangramento de maior vulto, tendo tido necessidade de receber concentrado de hemácias. Risco aumentado foi observado por pacientes que necessitavam de pressões ventilatórias mais elevadas e falência orgânica sistêmica.
Condições de risco especificas são, algumas vezes, inerentes à própria doença de base e só identificadas no paciente, por ocasião de um primeiro episódio de sangramento digestivo. São ligados a uma condição ou doença prévia, como acontece com distúrbios de coagulação (deficiência de vitamina K, deficiência congênita de fatores de coagulação, como hemofilia, doença de Von Willebrand), bem como a hipertensão porta por doença hepática crônica, ou alterações congênitas, como a duplicação intestinal ou o divertículo de Meckel. Nestes pacientes, a HDA pode ocorrer desencadeada por doenças agudas infecciosas ou não, em que os vômitos, que em outro paciente sem estas alterações (deficiência de fatores, varizes de esôfago, trombocitopenia, alterações anatômicas), por si só não seriam suficientes para ocasionar hemorragia, ou fazê-lo em intensidade expressiva.18
EXAMES DE EXTREMA IMPORTÂNCIA
Alguns testes e exames são importantes e decisivos na tomada de conduta frente ao paciente com hemorragia digestiva, pois definem causas e/ou origem do sangramento:19
a) Apt-Downey test - colhe-se material eliminado pelo recém-nascido por vômito ou fezes e, tratando-o com hidróxido de sódio, identifica-se como de origem materna ou neonatal o sangue eliminado; quando o sobrenadante toma cor amarelada/acastanhada ou rosada respectivamente;20
b) exame do aspirado gástrico - colhe-se o aspirado por meio de sonda nasogástrica, passada na fase inicial para preparar o paciente para um possível procedimento endoscópico. Usando-se o Gastrocult, identifica-se a presença de vestígio de sangue no material aspirado;21
c) fezes com sangue oculto ou suspeito - a partir de material de fezes ou colhido por exame retal, acrescenta-se o Hemocult (teste do guáiaco), que, reagindo com o peróxido de hidrogênio, na presença do heme produz composto de coloração azulada e confirma a presença de sangue;
d) endoscopia - visualização por meio de aparelhos de fibra ótica ou vídeo, é realizada caso o paciente necessite transfusão de urgência, apresente instabilidade hemodinâmica, ou nas primeiras 24 horas, em caso de não urgência. A hemostasia de lesão sangrante no esôfago (variz esofágica) ou gástrica/duodenal (úlcera com vaso sangrante) pode ser essencial para estabilização do quadro;
e) angiografia - estudo com contraste arterial somente. Se for identificado extravasamento extravascular, pode ter taxa de diagnóstica de 64% com acurácia maior na HDA aguda (71%) comparado à baixa quando crônica ou recorrente (55%). É especialmente importante quando a endoscopia não consegue localizar e cessar o sangramento.22,23
EXAMES DE AVALIAÇÃO GERAL
De acordo com a situação hemodinâmica geral do paciente são necessários exames de tipagem sanguínea, avaliação da série vermelha (hematócrito e hemoglobina) e série branca, estudos da coagulação (TAP, PTT, dosagem do fibrinogênio), avaliação de lesão e função hepáticas (transaminases, bilirrubinas, fosfatase alcalina, gama-GT) e função renal (ureia e creatinina) e marcadores inflamatórios (VHS e proteína C reativa). Pacientes com história de dor abdominal também deverão dosar amilase e lipase, em virtude de ocasionalmente pancreatite se associar a gastrite, duodenite e doença péptica ulcerosa. Pacientes com HDA volumosa, ou com história de sangramento anterior por varizes esofágicas sempre deverão, além da tipagem sanguínea, fazer prova cruzada e deixar concentrado de hemácias e plasma fresco reservados. Pacientes com sangramento digestivo e aumento da ureia provavelmente o fazem em consequência da degradação dos aminoácidos por ocasião da digestão das células vermelhas; este aumento não ocorre na HDB, contudo a ausência da elevação não exclui a possibilidade de que o sangramento seja de origem alta.10,24
No caso do sangramento digestivo baixo, também são importantes marcadores sorológicos das doenças inflamatórias intestinais (p-ANCA, ASCA), além de pesquisas fecais bacteriológicas: Salmonella, Shigella, toxinas A e B de Clostridium difficile, Yersinia, Campylobacter e Escherichia coli, virológicas: citomegalovírus em imunodeprimidos e parasitárias - ovos, larvas e protozoários, teste do guáiaco, dosagem da lactoferrina e calprotectina (marcadores de inflamação intestinal).
AVALIAÇÃO CLÍNICA E ABORDAGEM INICIAL
A avaliação das condições hemodinâmicas em paciente com sangramento digestivo é uma das medidas iniciais mais importantes: sinais vitais, incluindo frequência cardíaca e pressão arterial, considerando as alterações produzidas na modificação da posição de deitada para a ortostática, além do enchimento capilar. Havendo instabilidade hemodinâmica, o paciente deverá ter seu tratamento conduzido em UTI, com monitoramento constante dos parâmetros considerados.
Alguns parâmetros indicam gravidade em um episódio de sangramento digestivo, principalmente quando ocorrem associados à HDA, como descrito abaixo. Estes sinais de gravidade também indicam necessidade de avaliação de endoscopia de urgência:24
a) associação de melena ou hematoquezia;
b) aumento de 20 batimentos por minuto em relação à média para a faixa etária em questão;
c) prolongamento do tempo de enchimento capilar (acima de três segundos);
d) queda da hemoglobina acima de 2 g/dl;
e) necessidade de infusão venosa em grandes volumes;
f) necessidade de transfusão de hemoderivados considerando Hg menor que 8 g/dl.
CONDUTA NA HDA
A medida mais importante no paciente com hemorragia digestiva pode ser a reposição volêmica, que deve ser feita de acordo com normas de tratamento da hipovolemia e/ou choque. Para tanto, o acesso venoso profundo ou intraósseo pode ser necessário para o estabelecimento da via de infusão da solução de expansão.
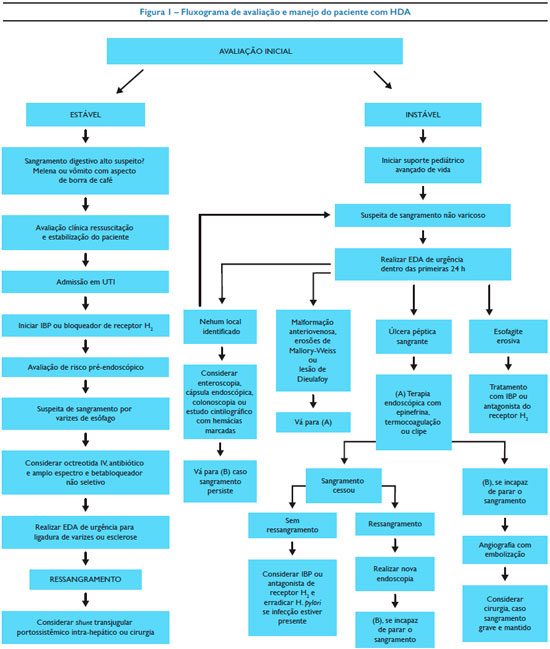
Em virtude da maioria dos pacientes com HDA terem maior risco de apresentar quadros de maior expressão ou gravidade, apresentamos um fluxograma de avaliação e manejo do paciente com HDA na figura 1.19
MEDIDAS GERAIS NOS PACIENTES COM GRANDE VOLUME DE PERDA OU INSTABILIDADE HEMODINÂMICA
A seguir, as medidas apresentadas são usadas na maioria dos pacientes com HDA e algumas delas também em casos de HDB.
Sondagem Oro ou Nasogástrica
Em pacientes com perda inexplicada (acima de uma colher de chá), determinar a origem ou a continuidade do processo, mesmo naqueles com suspeita de varizes de esôfago, pois já se inicia o preparo do paciente para ser submetido à endoscopia de urgência, removendo o sangue visando facilitar o procedimento. A lavagem deve ser feita com solução salina à temperatura ambiente, pois não há vantagem no uso da solução gelada e esta ainda aumenta o risco de hipotermia nos lactentes e crianças.25
A saída de sangue pela sonda gástrica confirma a origem gastrointestinal alta ou nasofaríngea. Poderá ser negativa caso o sangramento tenha cessado ou seja abaixo de um piloro fechado. Caso haja presença de bile, o piloro está aberto, e se não se detecta sangue não existe sangramento ativo.
Supressão Ácida
Pacientes instáveis ou sangramento de grande volume - inibidor de bomba de prótons (IBP) intravenoso:
a) esomeprazol - 0,5 mg/kg/dose em dose única diária (lact);
b) crianças de 1 a 17 anos com menos de 55 kg - 10 mg dose única diária;
c) crianças de 1 a 17 anos com 55 kg ou mais - 20 mg dose única diária;
d) pantoprazol - 1 a 2 mg/kg/dia em dose única ou 40 mg/1,73 m2/dia (máximo 80 mg);
e) bloqueador H2 - caso IBP indisponível;
ranitidina - lactentes, crianças e adolescentes: 2 a 5 mg/kg/dia IV dividido a cada seis ou oito horas (máximo 200 mg/dia) ou infusão venosa contínua - 1 mg/kg IV in bólus (máx. 50 mg) seguido de 2 a 4 mg/kg/dia (máx. 6,25 mg/h);f) pacientes estáveis - IBP oral;
g) omeprazol - 1 a 3 mg/kg/dia (máx. 80 mg) em uma ou duas doses;
h) esomeprazol - lactentes de 1 mês até 1 ano:
- 3 a 5 kg - 2,5 mg;
- 5 a 7,5 kg - 5 mg;
- 7,5 a 12 kg - 10 mg;i) crianças de 1 a 11 anos (diária):
- abaixo de 20 kg - 10 mg;
- acima de 20 kg - 10 ou 20 mg;j) crianças acima de 12 anos e adultos:
- 40 mg duas vezes ao dia seguido de 20 a 40 mg uma vez ao dia (manutenção);k) pantoprazol - crianças de 5 a 11 anos:
- 15 a 40 kg - 20 mg uma vez ao dia;
- 40 kg - dose de adulto;l) crianças 12 anos ou mais:
- 40 mg duas vezes ao dia seguido de 20 a 40 mg uma vez ao dia (manutenção).
Agentes Vasoativos
Reduzem o fluxo venoso portal, diminuindo a pressão a nível da variz. Podem ser usados como coadjuvantes da endoscopia alta, na impossibilidade ou em caso de contraindicação desta. Usados em sangramento por varizes esofágicas (história prévia) ou suspeita. Diminuem o fluxo sanguíneo esplâncnico sem reduzir a pressão arterial.
Medicamentos disponíveis:
a) octreotida - 1 a 2 mcg/kg IV in bólus (máx. 50 mcg) seguido de 1 a 2 mcg/kg/h como infusão contínua (máx. 50 mcg/h). A dose inicial in bólus pode ser repetida uma vez na primeira hora se necessário. Bradicardia e hiperglicemia são efeitos adversos;26
b) somatostatina - 1 a 2 mcg/kg IV direto seguido de 1-2 mcg/kg/h em infusão contínua, regulando de acordo com a resposta. Redução da dose 50% a cada 12 horas e retirada quando em 25% da dose inicial;
c) betabloqueadores não seletivos - propranolol 0,5 a 2 mg/kg/dia, dividido em duas a quatro doses com o intuito de reduzir a frequência cardíaca para 75% do normal para a idade (contraindicado para pacientes asmáticos, bradicárdicos ou com choque cardiogênico). Efeito maior como profilático do sangramento inicial ou ressangramento em pacientes com varizes de esôfago.27
Endoscopia Digestiva Alta
Deve ser feita logo que possível em sangramentos agudo graves ou contínuos dentro das primeiras 24-48 horas. É o método mais importante a ser realizado nos casos de HDA, pois, além de elevada sensibilidade e especificidade, tem possibilidades terapêuticas.28 Contudo, a realização de endoscopia digestiva em paciente instável hemodinamicamente ou com sangramento alto grave, é procedimento com risco muito maior do que a endoscopia com fins de diagnóstico em paciente sem HDA. Deve ser feita sob anestesia e preferencialmente com o paciente entubado, visando proteger a via aérea da aspiração de material gástrico e de sangue.
As estratégias terapêuticas são realizadas por meio da intervenção com uso de substâncias esclerosantes, epinefrina em solução diluída (ou associação das duas), termocoagulação por contato ou com plasma de argônio ou mesmo aplicação de ligaduras elásticas em varizes e de hemoclipes em lesões focais, não varicosas, com pontos de sangramentos identificáveis. A intervenção endoscópica pode ser dificultada em crianças muito pequenas, em virtude de o diâmetro dos endoscópios serem um pouco maior que os endoscópios habituais.29
Protocolos de acompanhamento dos pacientes que ressangram implicam no estabelecimento de algumas definições:
a) tempo zero - momento da admissão do paciente;
b) episódio de sangramento agudo - intervalo de 120 horas a partir do tempo zero;
c) falha do tratamento - definido se qualquer dos critérios abaixo ocorrer dentro de 120 horas do tempo zero (experiência dos adultos);
d) hematêmese em sangue vivo ou acima de 100 ml menos de duas horas após o início de droga específica ou tratamento endoscópico;
e) evolução para choque hipovolêmico;
f) queda de hemoglobina de 3 g em 24 horas;
g) ressangramento precoce - ocorrendo de 120 horas do início até seis semanas (considerando-se uma hemostasia inicial com sucesso por pelo menos 24 h);
h) ressangramento tardio - ocorrendo após seis semanas do início.
OUTROS MÉTODOS IMPORTANTES NA HEMORRAGIA DIGESTIVA
A angiografia para localização de sangramento obscuro que não foi identificado ou não se conseguiu controlar com intervenção endoscópica pode ser usada para identificação do sangramento e até mesmo para embolização, ou seja, com fins terapêuticos.22
A cintilografia com tecnécio pode ser usada para identificação de divertículo de Meckel em casos de HDB, mas também pode ser feita usando-se hemácias marcadas com radionuclídeo para identificar local obscuro de sangramento em HDA ou HDB.29
Em relação ao manejo da HDB, apresentamos apenas um fluxograma de encaminhamento do paciente para o exame endoscópico (Figura 2), lembrando que outros exames, como a enteroscopia e a videoendoscopia por cápsula endoscópicas, podem ser importantes. Da mesma forma a avaliação inicial do paciente deve garantir a estabilização hemodinâmica quando for necessário.9
CIRURGIA
A cirurgia para tratamento das varizes de esôfago é realizada nas seguintes situações: sangramento das varizes, apesar do tratamento endoscópico, hiperesplenismo sintomático com trombocitopenia, disfunção hepática associada à trombose de veia hepática. Realizada eletivamente, pode ser uma estratégia importante do paciente com complicações graves.31
O shunt transjugular portossistêmico intra-hepático tem sido uma alternativa para os pacientes adultos com sangramento digestivo por varizes esofágicas. Trata-se da criação de um sistema de baixa resistência entre a veia hepática e a porção intra-hepática da veia porta por acesso através da jugular externa. Existem alguns relatos de uso em crianças com síndrome de Budd-Chiari.32,33
CONSIDERAÇÕES FINAIS
Finalizando, a abordagem do paciente com hemorragia digestiva deve ser conduzida de acordo com a situação clínica em que este se encontra. A necessidade do exame endoscópico, para a maioria das crianças com HDA, não implica em encaminhar o paciente para o exame sem avaliação clínica detalhada. O diagnóstico topográfico e a localização do sítio de sangramento são tão importantes quanto a manutenção das condições hemodinâmicas do paciente, ressaltando que informações de história e do exame físico, associados aos dados epidemiológicos são tão essenciais quanto os métodos de imagem e endoscópicos que na maioria das vezes encerram a questão do diagnóstico e tratamento de urgência.
REFERÊNCIAS
1 Raju GS, Gerson L, Das A, Lewis B; American Gastroenterological Association. American Gastroenterological Association (AGA) Institute technical review on obscure gastrointestinal bleeding. Gastroenterology. 2007;133(5):1697-717.
2 Carvalho E, Nita MH, Paiva LMA, Silva AAR. Gastrointestinal bleeding. J Pediatr (Rio J). 2000;76(suppl 2):S135-46.
3 Brown K, Lundborg P, Levinson J, Yang H. Incidence of peptic ulcer bleeding in the US pediatric population. J Pediatr Gastroenterol Nutr. 2012;54(6):733-6.
4 Teach SJ, Fleisher GR. Rectal bleeding in the pediatric emergency department. Ann Emerg Med. 1994;23(6):1252-8.
5 Balachandran B, Singhi S. Emergency management of lower gastrointestinal bleed in children. Indian J Pediatr. 2013;80(3):219-25.
6 Kay M, Eng K, Wyllie R. Colonic polyps and polyposis syndromes in pediatric patients. Curr Opin Pediatr. 2015;27(5):634-41.
7 Brasil. Ministério da Saúde. Datasus. Informações de saúde (Tabnet). Epidemiológicas e morbidade. Disponível em: http://www2.datasus.gov.br/DATASUS/index.php?area=0203. Acesso em: 11 dez. 2017.
8 Chawla S, Seth D, Mahajan P, Kamat D. Upper gastrointestinal bleeding in children. Clin Pediatr (Phila). 2007;46(1):16-21.
9 Sahn B, Bitton S. Lower gastrointestinal bleeding in children. Gastrointest Endosc Clin N Am. 2016;26(1):75-98.
10 Pai AK, Fox VL. Gastrointestinal bleeding and management. Pediatr Clin North Am. 2017;64(3):543-61.
11 Lesko SM, Mitchell AA. An assessment of the safety of pediatric ibuprofen. A practitioner-based randomized clinical trial. JAMA. 1995;273(12):929-33.
12 Grimaldi-Bensouda L, Abenhaim L, Michaud L, Mouterde O, Jonville-Béra AP, Giraudeau B et al. Clinical features and risk factors for upper gastrointestinal bleeding in children: a case-crossover study. Eur J Clin Pharmacol. 2010;66(8):831-7.
13 Berezin SH, Bostwick HE, Halata MS, Feerick J, Newman LJ, Medow MS. Gastrointestinal bleeding in children following ingestion of low-dose ibuprofen. J Pediatr Gastroenterol Nutr. 2007;44(4):506-8.
14 Pacifico L, Anania C, Osborn JF, Ferraro F, Chiesa C. Consequences of Helicobacter pylori infection in children. World J Gastroenterol. 2010;16(41):5181-94.
15 Boukthir S, Mazigh SM, Kalach N, Bouyahya O, Sammoud A. The effect of non-steroidal anti-inflammatory drugs and Helicobacter pylori infection on the gastric mucosa in children with upper gastrointestinal bleeding. Pediatr Surg Int. 2010;26(2):227-30.
16 Cochran EB, Phelps SJ, Tolley EA, Stidham GL. Prevalence of, and risk factors for, upper gastrointestinal tract bleeding in critically ill pediatric patients. Crit Care Med. 1992;20(11):1519-23.
17 Lopez-Herce J, Dorao P, Elola P, Delgado MA, Ruza F, Madero R. Frequency and prophylaxis of upper gastrointestinal hemorrhage in critically ill children: a prospective study comparing the efficacy of almagate, ranitidine, and sucralfate. The Gastrointestinal Hemorrhage Study Group. Crit Care Med. 1992;20(8):1082-9.
18 Saxonhouse MA, Manco-Johnson MJ. The evaluation and management of neonatal coagulation disorders. Semin Perinatol. 2009;33(1):52-65.
19 Owensby S, Taylor K, Wilkins T. Diagnosis and management of upper gastrointestinal bleeding in children. J Am Board Fam Med. 2015;28(1):134-45.
20 Crook M. Haemoglobin in stools from neonates: measurement by a modified Apt-test. Med Lab Sci. 1991;48(4):346-7.
21 Rosenthal P, Thompson J, Singh M. Detection of occult blood in gastric juice. J Clin Gastroenterol. 1984;6(2):119-21.
22 Defreyne L, Vanlangenhove P, De Vos M, Pattyn P, Van Maele G, Decruyenaere J et al. Embolization as a first approach with endoscopically unmanageable acute nonvariceal gastrointestinal hemorrhage. Radiology. 2001;218(3):739-48.
23 Rollins ES, Picus D, Hicks ME, Darcy MD, Bower BL, Kleinhoffer MA. Angiography is useful in detecting the source of chronic gastrointestinal bleeding of obscure origin. AJR Am J Roentgenol. 1991;156(2):385-8.
24 Freedman SB, Stewart C, Rumantir M, Thull-Freedman JD. Predictors of clinically significant upper gastrointestinal hemorrhage among children with hematemesis. J Pediatr Gastroenterol Nutr. 2012;54(6):737-43.
25 Gilbert DA, Saunders DR. Iced saline lavage does not slow bleeding from experimental canine gastric ulcers. Dig Dis Sci. 1981;26(12):1065-8.
26 Eroglu Y, Emerick KM, Whitingon PF, Alonso EM. Octreotide therapy for control of acute gastrointestinal bleeding in children. J Pediatr Gastroenterol Nutr. 2004;38(1):41-7.
27 Samanta T, Purkait R, Sarkar M, Misra A, Ganguly S. Effectiveness of beta blockers in primary prophylaxis of variceal bleeding in children with portal hypertension. Trop Gastroenterol. 2011;32(4):299-303.
28 Wilkins T, Khan N, Nabh A, Schade Rr. Diagnosis and management of upper gastrointestinal bleeding. Am Fam Physician. 2012;85(5):469-76.
29 Kay MH, Wyllie R. Therapeutic endoscopy for nonvariceal gastrointestinal bleeding. J Pediatr Gastroenterol Nutr. 2007;45(2):157-71.
30 Finn LS, Christie DL. Helicobacter pylori and Meckel's diverticula. J Pediatr Gastroenterol Nutr. 2001;32(2):150-5.
31 Lillegard JB, Hanna AM, McKenzie TJ, Moir CR, Ishitani MB, Nagorney DM. A single-institution review of portosystemic shunts in children: an ongoing discussion. HPB Surg. 2010. doi:10.1155/2010/964597
32 Nobre S, Khanna R, Bab N, Kyrana E, Height S, Karani J et al. Primary Budd-Chiari syndrome in children: king's college hospital experience. J Pediatr Gastroenterol Nutr. 2017;65(1):93-6.
33 Huppert PE, Goffette P, Astfalk W, Sokal EM, Brambs HJ, Schott U et al. Transjugular intrahepatic portosystemic shunts in children with biliary atresia. Cardiovasc Intervent Radiol. 2002;25(6):484-93.