Número atual: 17(supl 1)(1) - 2017
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigos de Revisao
Traumatismo craniano em pediatria
Craniocerebral trauma in pediatrics
Raquel de Seixas Zeitel1; Rosana Andrade Flintz2; Carolina Castro Nogueras3
1. Médica-Pediatra no Serviço de Pediatria do Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro. Membro do Comitê de Emergência e Terapia Intensiva Pediátrica da Sociedade de Pediatria do Estado do Rio de Janeiro
2. Médica-Pediatra no Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro. Membro do Comitê de Emergência e Terapia Intensiva Pediátrica da Sociedade de Pediatria do Estado do Rio de Janeiro
3. Médica-Pediatra na Unidade Intensiva Pediátrica do Hospital Martagao Gesteira da Universidade Federal do Rio de Janeiro. Membro do Comitê de Emergência e Terapia Intensiva Pediátrica da Sociedade de Pediatria do Estado do Rio de Janeiro
Endereço para correspondência:
Recebido em: 4/9/2017 Aprovado em: 20/9/2017 Instituiçao: Hospital Universitário Pedro Ernesto
Resumo
INTRODUÇÃO: o traumatismo cranioencefálico na infância é causa frequente de atendimento nas emergências do Brasil e do mundo. Reconhecer precocemente a gravidade do traumatismo cranioencefálico e oferecer o manejo adequado reduz, de forma acentuada, a morbimortalidade.
OBJETIVO: apresentar uma revisão atualizada da classificação do trauma craniano em pediatria, discutindo o manejo em condutas atualizadas, bem como suas complicações. Revisar as indicações da tomografia e a conduta frente aos casos mais graves até a transferência para unidade de terapia intensiva.
FONTE DE DADOS: base de dados Medline e Biblioteca Virtual em Saúde. Artigos científicos e guidelines sobre trauma cranioencefálico, publicados de 1991 a 2017, foram selecionados e analisados.
SÍNTESE DOS DADOS: no curso deste artigo, abordamos a fisiopatologia do trauma cranioencefálico, assim como a sua classificação em leve, moderada e grave, focando no manejo adequado desses pacientes.
CONCLUSÃO: o traumatismo craniano em pediatria é, majoritariamente, classificado como leve, mas os casos graves ainda apresentam mortalidade alta com grande ocorrência de sequelas. O tratamento adequado do trauma craniano e de suas complicações é indispensável na redução da morbimortalidade.
Palavras-chave: Traumatismos craniocerebrais; Criança; Edema encefálico.
Abstract
INTRODUCTION: cranioencephalic trauma during infancy is a frequent cause of medical care at emergency care units in Brazil and around the world. Early recognition of cranioencephalic trauma severity and its correct management greatly reduce morbidity and mortality.
OBJECTIVE: to present an up-dated review of the cranioencephalic trauma in pediatrics, discussing the management in up-dated conducts and its complications. To review the indications of the tomography and the conduct in relation to the most critical cases until the transfer to the intensive care unit.
DATA SOURCE: Medline database and "Biblioteca Virtual em Saúde". Scientific articles and guidelines about cranioencephalic trauma published from 1991 to 2017 were selected and analyzed.
DATA SYNTHESIS: in the course of this article, we addressed the physiopathology of cranioencephalic injuries as well as its classification in mild, moderate and severe, focusing on the adequate management of these patients.
CONCLUSIONS: the cranioencephalic trauma in pediatrics is in the most cases classified as light, but the critical cases still present high mortality with high probability of sequelae. The adequate treatment of the cranioencephalic trauma and its complications is indispensable in order to reduce morbidity and mortality.
Keywords: Craniocerebral trauma; Child; Brain edema.
INTRODUÇÃO
Traumatismo cranioencefálico (TCE) na infância é causa comum de atendimento nas emergências pediátricas. O TCE é responsável por mais de 600.000 consultas por ano em emergências pediátricas nos EUA1 e a principal causa de morbimortalidade em crianças no mundo. No Reino Unido, estima-se uma taxa de mortalidade de 5,3 mortes a cada 100.000 crianças, chegando a 23% nos casos graves.2
Dados da Organização Mundial da Saúde (OMS) mostram que o trauma por acidente automobilístico está entre as maiores causas de óbito entre crianças de 5 a 14 anos. Segundo o Ministério da Saúde (MS), 54,7% das internações no ano de 2012 foram por acidentes de transporte, quedas ou agressões na faixa etária de 0 a 14 anos. Se utilizarmos como referência a faixa etária entre 10 a 14 anos a taxa sobe para 58%. Dados mais recentes demonstram que de janeiro a setembro de 2017 foram registradas mais de 33 mil internações no Sistema Único de Saúde (SUS) classificadas como causas externas entre 5 e 9 anos. Não foram encontrados dados específicos para TCE na fonte relacionada.3 Além dos acidentes automobilísticos, as causas mais comuns de TCE em pediatria são atropelamentos, acidentes de bicicleta, quedas de altura e lesões decorrentes da prática esportiva. Já o TCE por abuso ou maus-tratos, pode ocorrer pela síndrome do bebê sacudido (shaken baby), por lesões diretas, lesões penetrantes ou por compressão. Nos menores de 1 ano de vida, a causa mais comum é a síndrome de bebê sacudido.4
A maior parte dos traumas cranianos em pediatria é leve, sem lesões cerebrais ou sequelas. Apenas 10% dos casos cursam com complicações graves.
MÉTODO
Foi realizada revisão não sistemática e analisados artigos e guidelines na base de dados Medline e na Biblioteca Virtual em Saúde (BVS) publicados de 1991 a 2017, utilizando as palavras-chave 'trauma', 'cranioencefálico', 'criança' e 'edema cerebral'.
RESULTADOS
A seguir, apresentaremos os resultados da presente revisão de literatura.
FISIOPATOLOGIA
As lesões cerebrais no trauma podem ser classificadas como primárias ou secundárias. As lesões primárias ocorrem no momento do acidente, seja por impacto, seja por forças de aceleração e desaceleração. Ruptura de vasos, lesão axonal difusa, contusão cerebral, fraturas e laceração são exemplos dessas lesões. A desproporção do tamanho da cabeça em relação ao tronco quando comparado ao adulto e o maior conteúdo de água, bem como a mielinização incompleta, potencializam os efeitos das forças inerciais, aumentando a frequência de lesões cerebrais difusas nas crianças.
Após a instalação dessas lesões, ocorre o edema cerebral, que pode ser citotóxico ou de origem vasogênica. O edema citotóxico é decorrente de uma falha na bomba Na+/K+, dependente de trifosfato de adenosina (ATP) por isquemia cerebral, levando à entrada de água na célula. O edema vasogênico caracteriza-se pela quebra da barreira hematoencefálica com extravasamento do conteúdo vascular para o parênquima cerebral. Este é o componente mais importante no aumento da pressão intracraniana (PIC).
As lesões secundárias resultam das lesões primárias, contribuindo para perda neuronal. São elas: redução da perfusão cerebral, hipertermia, hiperglicemia, hiponatremia, hipóxia e hipercapnia. A intervenção terapêutica no tratamento do TCE tem por objetivo tratar o edema e as lesões secundárias, além de reduzir o aparecimento das sequelas.
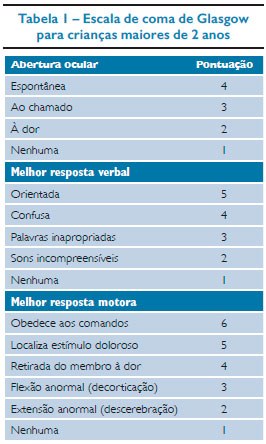
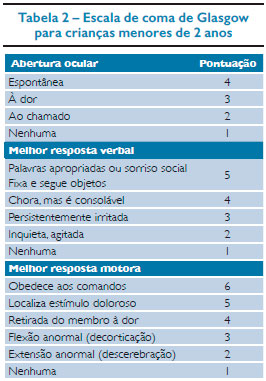
O TCE pode ser classificado como mínimo, leve, moderado ou grave.8 O trauma mínimo ocorre quando o paciente não apresenta alterações focais no exame neurológico, escala de coma de Glasgow: 13-15, sem evidências de fraturas. Atenção especial deve ser dada a crianças menores de 2 anos pela ocorrência de fraturas e lesões graves na ausência de alterações clínicas.1,5 No trauma de crânio leve, assim como no trauma mínimo, os pacientes apresentam Glasgow entre 13-15, porém estas crianças têm perda da consciência, desorientação ou vômitos. Pacientes com trauma moderado apresentam pontuação na escala de coma de Glasgow entre 9-12 e no trauma grave, Glasgow igual ou menor que 8.
INDICAÇÕES PARA REALIZAÇÃO DOS EXAMES DE IMAGEM
A radiografia de crânio não é indicada, pois não consegue excluir lesões se estiver normal e se alterada indica a realização da tomografia de crânio. O uso indiscriminado da realização de tomografias de crânio para pacientes, mesmo com traumas mínimos, tem sido motivo de preocupação dos órgãos de saúde pela possibilidade de ocorrência de câncer e pela exposição do sistema nervoso em desenvolvimento à radiação.
Diversos estudos têm sido desenvolvidos com esse tema e especialistas publicaram suas recomendações. A Academia Americana de Pediatria orienta realizar a tomografia em pacientes com Glasgow menor ou igual a 14 e alteração do estado mental, na deterioração do quadro clínico ou piora dos sintomas, na presença de sinais focais, piora da cefaleia, prolongada perda da consciência, convulsões após o trauma ou prolongadas, sinais de fratura ou lesão penetrante, doença pré-existente com aumento do risco de hemorragias. Nas crianças menores de 2 anos, orienta considerar irritabilidade, abaulamento da fontanela, vômitos persistentes e hematomas, exceto os de localização frontal.1
Schutzman e colaboradores9 publicaram recomendações especiais para crianças menores de 2 anos com TCE leve baseado no risco de lesão intracraniana. São considerados de alto risco para lesão intracraniana: rebaixamento do nível de consciência, sinais focais, fratura ou afundamento de crânio, abaulamento de fontanela, convulsão, perda da consciência por mais de um minuto, mais de cinco ou seis vômitos por hora. Nestes casos, é recomendada a realização de tomografia de crânio. Risco intermediário para lesão intracraniana: três ou quatro episódios de vômitos, perda da consciência (por um minuto ou menos), alteração do comportamento, história de irritabilidade ou letargia já resolvida, fratura de crânio com mais de 24 horas de evolução. Já nesses casos, a recomendação é realizar tomografia, ou observar por quatro a seis horas. Os quadros leves nos quais a observação é recomendada e a tomografia desaconselhada são: paciente com ausência de sinais ou sintomas duas horas após o trauma e quedas menores de um metro. O paciente deve ser observado por um período de quatro a seis horas e liberado para casa com orientação de retorno para avaliação, caso o quadro clínico se deteriore ou ocorra o aparecimento de novos sintomas. As recomendações devem estar escritas e detalhadas aos responsáveis. Os pacientes suspeitos de lesão por abuso devem ser investigados e notificados. Algumas alterações no exame físico e/ou nos exames de imagem sugerem lesões intencionais como: hemorragia retiniana; hematoma subdural crônico bilateral; fraturas múltiplas de crânio ou de ossos longos; queimaduras e lesões em diferentes estágios de evolução. Para estas crianças, está indicada a realização da tomografia de crânio e de radiografias à procura de fraturas novas ou consolidadas em outras partes do corpo. Casos especiais, como quando não se conhece o mecanismo do trauma ou trauma não presenciado, também indicam tomografia.
MANEJO DO PACIENTE COM TRAUMA CRANIANO
Todo paciente vítima de TCE deve ser avaliado em até 15 minutos da entrada na emergência.5 A avaliação consistirá na anamnese e no exame físico.
Avaliação Inicial
A presença de amnesia pós-trauma (impossível de avaliar no lactente e na criança jovem), perda da consciência, convulsões, cefaleia, vômitos, instabilidade postural, zumbidos, alteração de comportamento podem ser indicativos de lesão cerebral. A história deve ser objetiva e constar o ambiente e mecanismo do trauma, medicamentos em uso, patologias anteriores, ingestão de líquidos e alimentos recentemente e alergias (mnemônico ambiente e mecanismo do trauma, medicamentos, patologias pregressas, última refeição, alergia - AMPLA).
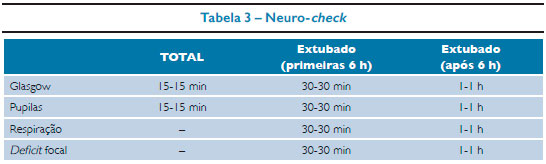
O exame físico deve incluir o exame neurológico com avaliação do neuro-check, que consiste em exame pupilar, fotorreação, pontuação da escala de coma de Glasgow adequada para idade (Tabelas 1 e 2) e avaliação de sinais focais. Palpação da fontanela (se presente), sinais de fratura da base do crânio: hematoma retroauricular (sinal de Battle), hematoma periorbital (olhos de panda), hemotímpano, otorreia ou rinorreia de líquor (LCR), presença de fraturas ou hematomas também podem ser encontrados.
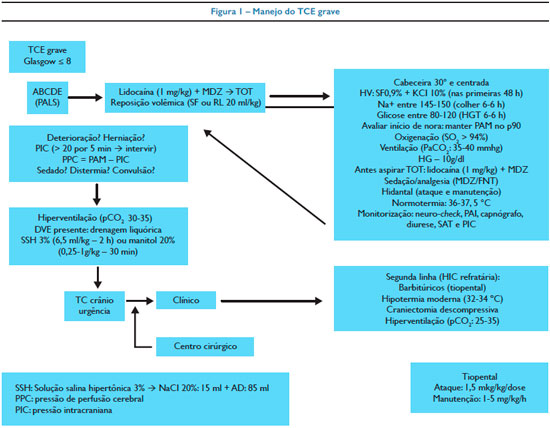
O atendimento inicial é baseado no método ABCDE. A primeira avaliação consiste na estabilização da coluna cervical e verificação da via aérea. Segurada a estabilização da coluna cervical em traumas moderados e graves, deve ser garantida a perviedade da via aérea. Na presença de sangue ou secreções, elas devem ser aspiradas e elevado o mento para evitar obstrução. Nos casos de rebaixamento do nível de consciência, essas medidas também são recomendadas. Quando a pontuação na escala de coma de Glasgow é menor que 8 ou na queda rápida do Glasgow (queda maior que dois pontos durante a avaliação), é indicada a intubação. Outros critérios para entubação incluem hipoxemia refratária à oxigenoterapia, hipercarbia (PaCO2 > 45 mmHg), anisocoria, lesão espinhal cervical comprometendo a ventilação, perda do reflexo faríngeo, sinais clínicos de herniação (tríade de Cushing: hipertensão arterial, bradicardia e respiração irregular).
Ao proceder a intubação dos traumas cranianos, é preconizado o uso da sequência rápida de intubação, que consiste na combinação de medicações, a fim de evitar o aumento da pressão intracraniana. Primeiramente, o paciente deve receber oxigênio suplementar e deve ser posicionado evitando a hiper-extensão da cabeça nos casos suspeitos de trauma cervical. A sequência rápida de intubação deve ser aplicada em seguida e consiste em sedoanalgesia, bloqueador neuromuscular e lidocaína. Preferencialmente usamos midazolam (0,1-0,2 mg/kg), fentanil (1-2 mcg/kg), rocurônio (1 mg/kg) e lidocaína (1 mg/kg). A via preferencial para intubação é a orotraqueal. No passado, pensava-se que a cetamina aumentava a pressão intracraniana e o seu uso era evitado na sequência rápida de intubação com pacientes que apresentavam trauma cranioencefálico grave. No entanto, as evidências observacionais limitadas em crianças com trauma craniano severo indicaram que a pressão intracraniana não aumenta e que, em alguns pacientes, diminui a hipertensão intracraniana e mantém a pressão de perfusão cerebral.31,32 Lembrar que nos casos de trauma da base do crânio, a via nasal deve ser evitada tanto para intubação como para o posicionamento de sondas.
Após realizada a intubação, o paciente deve ser ventilado com parâmetros de suporte. O uso de elevadas pressões ventilatórias pode aumentar a pressão intracraniana. O objetivo da ventilação é manter a oxigenação (SatO2 > 95%), a ventilação (PaCO2 entre 35-45 mmHg) e o pH (7,35-7,45) adequados.
A maior parte do transporte de oxigênio ocorre ligado à hemoglobina, sendo assim, a anemia deve ser corrigida para manter a oxigenação. Alterações do CO2 devem ser evitadas. A hipercapnia (CO2 > 45 mmHg) causa vasodilatação com aumento da PIC e a hipocapnia (CO2 < 35 mmHg) pode gerar isquemia pela vasoconstrição cerebral. Dessa forma, a hiperventilação indiscriminada é contraindicada de rotina, com pior desfecho dos pacientes atribuído à isquemia.6,7 A indicação de hiperventilação fica restrita aos casos de hipertensão intracraniana com apresentação da tríade de Cushing (sinais de herniação iminente).
A avaliação da circulação inclui estado de hidratação, palpação dos pulsos periféricos e centrais, medida da pressão arterial (PA) e da frequência cardíaca (FC). Punção de dois acessos periféricos para reposição volêmica é recomendada. A adequada manutenção da PA objetivando um bom fluxo sanguíneo cerebral é indispensável para diminuir a morbidade desses casos. O recomendado é manter a PA sistêmica entre os percentis 5 e 50 para a idade. Para facilitar o manejo, podemos obter o percentil 5 pela seguinte fórmula: (idade × 2) + 70, e para calcular o percentil 50, basta somar mais 20. Nos casos de hipertensão intracraniana a pressão deve ser mantida elevada para garantir a pressão de perfusão cerebral (PPC) que é calculada pela diferença da pressão arterial média (PAM) e da PIC.

A hipotensão arterial precisa ser corrigida imediatamente com a administração rápida de fluidos isotônicos intravenosos, como o soro fisiológico ou ringer lactato a 20 ml/kg, que pode ser repetida até três vezes. Como a principal causa de choque em um paciente traumatizado é o choque hemorrágico, se não houver melhora após a expansão volêmica deve-se procurar fontes extracranianas de sangramento e realizar hemotransfusão. Soluções hipotônicas não devem ser prescritas, porque pioram o edema cerebral. Caso seja afastado sangramento, não retardar o início das aminas vasoativas. O próximo passo é associar um vasopressor e monitorar a PAM (e logo que possível a PIC e a PPC) para manter dentro dos valores adequados. A hipertensão é considerada uma resposta ao aumento da PIC para manter a PPC, sendo assim, o paciente que não esteja monitorado com cateter de PIC deve ser mantido com PA mais elevada.
Avaliação neurológica inclui o neuro-check, citado anteriormente. O paciente vítima de trauma craniano deve ser reavaliado constantemente, por meio desta prática, enquanto estiver no ambiente hospitalar. O objetivo neste momento é identificar sinais de hipertensão intracraniana (HIC). O aparecimento de novos sintomas ou a queda na escala de coma de Glasgow podem ser indicativos de deterioração neurológica, exigindo condutas específicas e imediatas (Figura 1). Por fim, o paciente deve ser exposto à procura de outras lesões, lacerações ou fraturas. A cabeça deve permanecer centrada e a 30º para facilitar o retorno venoso encefálico. Não puncionar a veia jugular para evitar mobilizações bruscas com consequentes aumentos na PIC.
A prescrição dos pacientes com trauma craniano merece atenção. A hidratação venosa deve ser preparada com solução fisiológica 0,9% e reposição de potássio, evitando-se soluções hipotônicas que agravam o edema cerebral, contribuindo para o aumento na hipertensão intracraniana e da injúria cerebral. Controle adequado dos eletrólitos, da osmolaridade sérica e da glicemia a cada seis horas são indispensáveis para evitar lesões secundárias e sequelas posteriores. A hipertermia deve ser evitada por aumentar o consumo de oxigênio no encéfalo, piorando o prognóstico do paciente.
Os casos moderados e graves de traumatismo craniano devem ser transferidos para a unidade de terapia intensiva (UTI), a fim de receber tratamento específico e avaliação do serviço de neurocirurgia.
Tratamento na UTI
Pacientes internados na UTI sofrem diversos estímulos nocivos e estresse que aumentam o metabolismo cerebral, o consumo de oxigênio e a PIC. Pela sua gravidade, o paciente deve ser monitorizado com pressão arterial intensiva e puncionado acesso venoso profundo. Deve ser evitada a punção das veias jugulares, a fim de evitar a alteração do retorno venoso cerebral.
Como sedativo utiliza-se em infusão contínua o benzodiazepínico (midazolam 0,1-0,3 mg/kg/hora) associado a um analgésico (fentanil 1-3 mcg/kg/hora). Cerca de 30 segundos antes das aspirações do tubo traqueal, deve ser administrada lidocaína (1 mg/kg) para evitar o reflexo da tosse, que pode causar aumento da PIC, associado a um benzodiazepínico.
O uso do propofol em infusão contínua não é recomendado pelo risco da síndrome de infusão do propofol (acidose metabólica severa, rabdomiólise, hipercalemia, insuficiência renal e morte em pacientes pediátricos).12,13 O risco do uso do bloqueador neuromuscular inclui hipoxemia, hipercarbia, devido a uma extubação não programada, mascarar crises convulsivas, pneumonia nosocomial, miopatia de doença crítica. O uso do bloqueador neuromuscular é reservado para os casos de HIC refratária, sendo necessário o uso de eletroencefalograma (EEG).
Controle e Prevenção dos Episódios Convulsivos
Epilepsia pós-traumática precoce é definida como a que ocorre nos primeiros sete dias após o trauma. Temos como fatores de risco a presença de afundamento, fraturas, contusão cerebral e fragmentos ósseos. Recomenda-se o uso de difenil-hidantoína (dose de ataque 15-20 mg/kg; manutenção 5-7 mg/kg/dia de 12/12 ou 8/8 horas), iniciada nas primeiras 24 horas após o trauma e mantido até o sétimo dia, se não forem observadas crises convulsivas.14
Suporte Nutricional
A Diretriz Pediátrica recomenda o início da dieta enteral nas primeiras 72 horas, após o trauma, e que o objetivo calórico seja atingido até o sétimo dia. A nutrição enteral é a preferida pelo seu efeito trófico no intestino, menor risco de infecção e de hiperglicemia. Nos pacientes com fratura de base de crânio, devido à lesão da placa cribiforme e o risco da passagem da sonda para o parênquima cerebral, é usada a sonda oroentérica. Caso ocorra contraindicação ao uso da via enteral, a via parenteral deve ser empregada.15
Lesões erosivas do trato gastrointestinal são comuns após graves traumatismos cranianos, justificando o uso do bloqueador sistêmico da acidez gástrica (ranitidina) ou inibidores da bomba de prótons (omeprazol).
Antitetânica
O estado vacinal deve ser checado e atualizado, principalmente na presença de lacerações e feridas contaminadas.
Corticoide
Não é indicado nos casos de TCE. Estudos demonstram maior mortalidade no grupo com corticoide.
EXAMES COMPLEMENTARES
Sugere-se colher bioquímica completa com eletrólitos, função renal, tipagem sanguínea com prova cruzada, hemograma, coagulograma e gasometria arterial. No trauma hepático, pancreático ou em suspeitas de maus-tratos, colhe-se função pancreática e hepática. Em casos de traumas suspeitos, realiza-se uma rotina toxicológica.
A tomografia computadorizada de crânio (TCC) é o método de imagem de escolha para pacientes com TCE grave. Feito inicialmente sem contraste, é um exame rápido que fornece várias informações capazes de definir se o tratamento inicial é clínico ou cirúrgico.
A ressonância nuclear magnética (RNM) é superior à TCC para detectar lesão axonal difusa e correlacionar o prognóstico ao longo tempo, porém é um exame que demora, precisa de sedação e nem sempre está disponível.
MONITORIZAÇÃO SISTÊMICA
Checagem da temperatura corporal, oximetria de pulso (saturação de oxigênio), monitorização cardíaca contínua, cateterismo vesical (diurese horária), PA invasiva (PAM e realização de exames seriados), capnografia (PaCO2) são rotinas necessárias.
MONITORIZAÇÃO CLÍNICA
O neuro-check é uma avaliação neurológia seriada e rápida, porém não substitui o exame neurológico completo. É realizado por meio do registro seriado da ECG; do tamanho, simetria e fotorreação das pupilas; do tipo de respiração e deficit neurológico focal.16 A ausência de alterações nesse exame sugere uma boa evolução do paciente.
A realização periódica do neuro-check identifica, de forma rápida, sinais e sintomas de uma iminente herniação cerebral, como pupila fixa dilatada unilateral ou bilateral, bradicardia, hipertensão arterial, postura de decorticação ou descerebração, possibilitando ao médico diagnosticar e iniciar o tratamento precoce da HIC. Nos casos suspeitos de herniação cerebral, deve-se iniciar imediatamente o tratamento clínico, realizar exame de imagem e contatar a neurocirurgia.
MONITORIZAÇÃO NEUROLÓGICA
Pressão Intracraniana
O tratamento da HIC deve ser iniciado quando a PIC atinge valores maiores de 20 mmHg, a fim de evitar a herniação cerebral. O uso do monitor de PIC é indicado em crianças com escala de coma de Glasgow(ECG) com valor menor ou igual a 8. Um cateter ligado ao transdutor permite medidas contínuas da PIC. Quando localizado no ventrículo lateral, essa conduta se torna diagnóstica e terapêutica, possibilitando a drenagem de líquor no momento do aumento da PIC. O monitor de PIC detecta HIC antes de aparecer sinais e sintomas de herniação cerebral.17
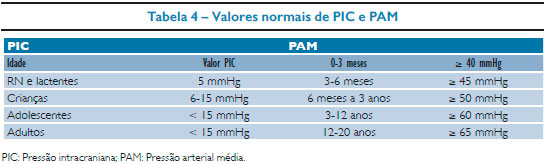
PPC
A PPC é obtida pela equação: PPC = PAM - PIC. Devemos manter valores de PPC em torno de 40 para recém-nascidos e lactentes e 60 para escolares e adolescentes (Tabela 4).
Cateter de Bulbo de Jugular
Colocação de um cateter na veia jugular interna, na altura do bulbo, é indicada nos casos de HIC. Esse cateter permite avaliar situações de isquemia. Valores abaixo de 55% indicam necessidade de oxigênio por parte dos tecidos, sugerindo isquemia de causa global (hipóxia, hipotensão, anemia) ou cerebral (herniação).
É uma boa monitorização, porém possui algumas limitações, como os fatores locais, que podem alterar essa medida, sem que isso signifique necessariamente um sofrimento cerebral importante.18
EEG
Método não invasivo que avalia as crises convulsivas, principalmente, se o paciente estiver em uso de bloqueadores neuromusculares (BNM), que dificultam o diagnóstico das crises. Muitas vezes, o aumento da PIC pode ser o único sinal de uma crise convulsiva elétrica sem repercussão motora.
Análise Biespectral (BIS)
Utilizado para monitorar o nível de anestesia/sedação, os valores variam entre 0 (sedação profunda) a 100 (desperto). Método não invasivo, utilizado para acompanhar o coma barbitúrico. Estudos sugerem que valores de BIS menores que 6 preconizam reduzir a dose do BBT, e valores maiores que 15 o aumento.19
Outros Métodos Promissores
São eles: a medida da pressão parcial de oxigênio tissular cerebral por meio de um cateter intraparenquimatoso. O valor de referência está entre 20 a 40 mmHg.20
A microdiálise consiste na passagem de um cateter intraparenquimatoso, em cuja extremidade distal se encontra uma membrana semipermeável, que permite difusão de água e de substâncias solúveis. Com isso, avaliamos o estado bioquímico do tecido cerebral de forma constante.20
TRATAMENTO DA HIPERTENSÃO INTRACRANIANA
O tratamento da HIC na injúria cerebral grave consiste na hiperventilação, drenagem de líquor e terapia hiperosmolar.
Hiperventilação
Ao se realizar hiperventilação, ocorre diminuição da PaCO2, que causa vasoconstricção, reduzindo o FSC (uma mudança de 1 mmHg na PaCO2 está associada a uma alteração de 3% no FSC) e, consequentemente, a PIC. Porém, esta manobra deve ser usada com cautela, uma vez que pode acarretar isquemia e hipoperfusão cerebral.21
A hiperventilação leve (PaCO2 = 30-35 mmHg) é considerada como primeira opção de tratamento nos casos de hipertensão intracraniana refratária, quando todas as medidas citadas anteriormente não foram efetivas.
A hiperventilação agressiva (PaCO2 ≤ 30 mmHg) pode ser considerada como terapia de segunda linha, porém é sugerida a monitorização da saturação venosa do bulbo de jugular ou do oxigênio cerebral tissular para identificar isquemia cerebral.22,23
Drenagem de Líquor
Reduz o valor da PIC nos pacientes com HIC. Quando ocorre edema cerebral difuso ou sangramento intracraniano, pode ser difícil a colocação desse monitor intraventricular.
Terapia Hiperosmolar
A solução salina hipertônica a 3% (SSH3%) e o manitol podem ser usados no controle da HIC. A SSH3% tem um mecanismo de efeito osmótico similar ao manitol, porém tem mais vantagens em crianças instáveis hemodinamicamente. A SSH3% preserva o volume intravascular,24,25 inibe a inflamação, estimula a liberação do peptídeo natriurético atrial e melhora o débito cardíaco. Enquanto aguardam novos estudos, a SSH3% (Nacl 20% 15 ml + AD 85 ml) pode ser administrada em bólus 6,5-10 ml/kg em duas horas ou em infusão contínua de 0,1-1 ml/kg/hora titulada para manter PIC menor que 20 mmHg.26,27 Durante o seu uso, a osmolaridade sérica (320 mOsm/l) deve ser monitorada e casos de insuficiência renal foram relatados. Outro cuidado durante o uso da SSH3% é com a mielinólise que pode ser da ponte, tálamo, gânglios28 da base e cerebelo. A mielinólise pode ocorrer com a hipernatremia e/ou durante a sua correção. O rebote da hipertensão intracraniana foi descrito com o uso do bólus da SSH3% ou depois da parada da infusão contínua. Mais estudos são necessários para comparar a administração de manitol com a SSH3%, como a dose e o resultado a longo prazo.
O manitol diminui a PIC por dois mecanismos. Primeiro ele reduz a viscosidade sanguínea por uma ação de vasoconstricção reflexa das arteríolas pelo mecanismo de autorregulação, diminuindo o volume de sangue cerebral e a PIC. Esse mecanismo é rápido, porém transitório; dura cerca de 75 minutos e precisa do mecanismo de autorregulação preservado.29,30 O segundo mecanismo do manitol é o efeito osmótico. Aumenta a osmolaridade sérica e causa a saída da água do parênquima cerebral para o espaço intravascular, diminuindo o edema celular e citotóxico. O início desse efeito é lento (15-30 minutos) e dura cerca de seis horas. Nas crianças com lesão cerebral grave, nas quais a barreira hematoencefálica não está intacta, o manitol pode acumular nas regiões de injúria cerebral e causar um desvio de água do intravascular para o parênquima cerebral, piorando o edema cerebral e aumentando a PIC. O manitol é um potente diurético osmótico e pode precipitar a hipotensão arterial e diminuir a PPC.¹² O manitol é administrado em bólus IV na dose de 0,25 g/kg até 1 g/kg.14
TRATAMENTO DE SEGUNDA LINHA PARA HIPERTENSÃO INTRACRANIANA
Nos casos de hipertensão intracraniana refratária, é realizada nova TCC para descartar uma causa cirúrgica. Caso as lesões cirúrgicas não existam, recomenda-se utilizar as medidas de segunda linha.
Barbitúrico (BBT)
Reduz a PIC por diminuir o metabolismo cerebral.14 O EEG deve ser realizado durante a administração do BBT para monitorar a resposta metabólica cerebral e identificar casos de crises convulsivas. O tiopental geralmente é utilizado na dose de ataque 1,5-5 mg/kg e manutenção 1-5 mg/kg/hora. O seu alvo é induzir surtossupressão no EEG. Os efeitos colaterais do uso do BBT são diminuição do débito cardíaco, da resistência vascular sistêmica e hipotensão arterial. Sugere-se, ao iniciar o uso do tiopental, monitorar hemodinamicamente o paciente e oferecer suporte cardiovascular. Lembrar que esses pacientes não podem ficar hipotensos pelo risco de isquemia.
Hipotermia
O papel da hipotermia não está definido. É reservada para os casos de hipertensão intracraniana refratária às outras intervenções terapêuticas e também se não houver contraindicação ao seu uso.14 Graves complicações estão associadas ao uso da hipotermia, como hipovolemia, distúrbio hidroeletrolítico (hipocalemia com consequente arritmia), coagulopatia e aumento da susceptibilidade para infecção.
Craniectomia Descompressiva
Reduz a PIC e mantém a PPC, prevenindo a herniação cerebral devido ao edema cerebral. Porém, a craniectomia descompressiva pode exacerbar a hemorragia e a formação do edema cerebral. Estudos estão sendo realizados para comprovar a segurança, a eficácia e o impacto da recuperação a longo prazo com esse procedimento cirúrgico.
CONSIDERAÇÕES FINAIS
O traumatismo craniano em pediatria é uma das principais causas de atendimento nas emergências. É importante a correta identificação da gravidade desses pacientes para melhor tratamento e prevenção das sequelas. Criar protocolos com essa finalidade ajudará na realização das práticas preconizadas, assim como dará agilidade ao atendimento desses pacientes.
Trabalhar com a prevenção é sempre a melhor maneira de cuidar e prover saúde à população. Sendo assim, trabalhar na prevenção de acidentes é fundamental para diminuirmos os casos de trauma cranioencefálico na infância.
REFERÊNCIAS
1 Schunk JE, Schutzman AS. Pediatric head injury. Pediatrics. 2012;33(9):398-411.
2 Parslow RC, Moris KP, Tasker RC, Forsyth RJ, Hawley CA; UK Paediatric Traumatic Brain Injury Study Steering Group et al. Epidemiology of traumatic brain injury in children receiving intensive care in the UK. Arch Dis Child. 2005;90(11):1182-7.
3 Brasil. Ministério da Saúde [internet]. Brasília: MS; 2010 [acesso em: 4 dez. 2017]. Disponível em: http://www.datasus.gov.br.
4 Duhaime AC, Christian CW, Rorke LB, Zimmerman RA. Nonaccidental head injury in infants - The "shaken-baby syndrome". N Engl J Med. 1998;338(25):1822-9.
5 Tasker RC. Acute management of head injury. Paed Child Health. 2010;20(9):416-23.
6 American College of Surgeons. Committee on Trauma. Advanced Trauma Life Support. 7. ed. 2004.
7 Muizelaar JP, Marmarou A, Ward JD, Kontos HA, Choi SC, Becker DP et al. Adverse effects of prolonged hyperventilation in patients with severe head injury: a randomized clinical trial. J Neurosurg. 1991;75(5):731-9.
8 Kortbeeck J, Al Turki SA, Ali J, Antoine JA, Bouillon B, Brasel K et al. Advanced trauma life support. 8. ed. The evidence for change. J Trauma. 2008;64(6):1638-50.
9 Schutzman AS, Barnes P, Duhaime AC, Greenes D, Homer C, Jaffe D et al. Evaluation and management of children younger than two years old with apparently minor head trauma: proposed guidelines. Pediatrics. 2001;107(5):983-93.
10 Caen AR, Berg MD, Chameides L, Gooden CK, Hickey RW, Scott HF et al. Part 12: Pediatric Advanced Life Support: 2015. American Heart Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardivascular Care. Circulation. 2015;132(suppl 2):S526-42.
11 Billota F, Branca G, Lam A, Cuzzone V, Doronzio A, Rosa G et al. Endotracheal lidocaine in preventing endotracheal suctioning-induced changes in cerebral hemodynamics in patient with severe head trauma. Neurocrit Care. 2008;8(2);241-6.
12 Bray RJ. Propofol infusion syndrome in children. Pediatr Anaesth. 1998;8(6):491-9.
13 Canivet JL, Gustad K, Leclercq P, Damas P, Lamy M. Massive ketonuria during sedation with propofol in a 12 year old girl with severe head trauma. Acta Anaesthesiol Belg. 1994;45(1):19-22.
14 Kochaneck PM, Carney N, Adelson PD, Ashwal S, Bell MJ, Bratton S et al. Guidelines for the acute medical management of severe traumatic brain injury in infants, children, and adolescents - Second edition. Pediatr Crit Care Med. 2012;13(suppl 1):s1-82.
15 Malakouti A, Sookplung P, Siriussawakul A, Philip S, Bailey N, Brown M et al. Nutrition support and deficiencies in children with severe traumatic brain injury. Pediatr Crit Care Med. 2012;13(1):18-24.
16 Associação de Medicina Intensiva Brasileira (Org.). Curso de Imersão em Terapia Intensiva Neurológica. São Paulo: AMIB,2013.
17 Abend NS, Helfaer MK. Pediatric Neurocritical Care. New York: DemosMEDICAL; 2013.
18 Carvalho WB, Hirschheimer MR, Matsumoto T. Terapia Intensiva Pediátrica. 3. ed. São Paulo: Atheneu; 2010.
19 Piva JP, Garcia PCR. Medicina Intensiva em Pediatria. 2. ed. Rio de Janeiro: Revinter; 2015.
20 Shaffner DH, Nichols DG. Roger'sTextbook of Pediatric Intensive Care. 5. ed. Wolters Kluwer Health; 2015.
21 Skippen P, Seear M, Poskitt K, Kestle J, Cochrane D, Annich G et al. Effect of hyperventilation on regional cerebral blood flow in head-injured children. Crit Care Med. 1997;25;(8):1402-9.
22 Cruz J, Nakayama P, Imamura JH, Rosenfeld KG, de Souza HS, Giorgetti GV. Cerebral extraction of oxigen and intracranial hypertension in severe, acute, pediatric brain trauma: preliminary novel management strategies. Neurosurgery. 2002;50(4):774-9; discussion 779-80.
23 Stiefel MF, Udoetuk JD, Storm PB, Sutton LN, Kim H, Dominguez TE, Helfaer MA et al. Brain tissue oxygen monitoring in pediatric patients with severe traumatic brain injury. J Neurosurg. 2006;105(suppl 4):281-6.
24 Prough DS, Whitley JM, Taylor CL, Deal DD, DeWitt DS. Regional cerebral blood flow following resuscitation from hemorrhagic shock with hypertonic saline. Influence of a subdural mass. Anesthesiology. 1991;75(2):319-27.
25 Qureshi Al, Suarez JL. Use of hypertonic saline solutions in treatment of cerebral edema and intracranial hypertension. Crit Care Med. 2000;28(9):3301-13.
26 Peterson B, Khanna S, Fisher B, Marshall L. Prolonged hypernatremia controls elevated intracranial pressure in head-injures pediatric patients. Crit Care Med. 2000;28(4):1136-43.
27 Khanna S, Davis D, Peterson B, Fisher B, Tung H, O'Quigley J et al. Use of hypertonic saline in the treatment of severe refractory posttraumatic intracranial hypertension in pediatric traumatic brain injury. Crit Care Med. 2000;28(4):1144-51.
28 Dominguez TE, Priestley MA, Huh JW. Caution should be exercised when maintaining a serum sodium level > 160 meq/L. Crit Care Med. 2004;32(6):1438-9.
29 Muizelaar JP, Lutz HA III, Becker DP. Effect of mannitol on ICP and CBF and correlation with pressure autoregulation in severely head-injured patients. J Neurosurg. 1984;61(4):700-6.
30 Muizelaar JP, Wei EP, Kontos HA, Becker DP. Mannitol causes compensatory cerebral vasoconstriction and vasodilation in response to blood viscosity changes. J Neurosurg. 1983;59(5):822-8.
31 Zeiler FA, Teitebaum J, West M, Gillman LM. The ketamine effects on ICP in traumatic brain injury. Neurocrit Care. 2014;21(1):163-73.
32 Bar-Joseph G, Guilburd Y, Tamir A, Guilburd JN. Effectiveness of ketamine in decreasing intracranial pressure in children with intracranial hypertension: clinical article. J Neurosurg: Pediatrics. 2009;4(1):40-6.