Número atual: 23(3) - Setembro 2023
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigos de Revisao
Evidências sobre a eficácia e segurança do canabidiol no tratamento da epilepsia infantil fármaco-resistente
Evidence on the efficacy and safety of cannabidiol in the treatment of drug-resistant childhood epilepsy
Michel Marcos Dalmedico1; Eduarda Sansigolo Bocchi2; Karina Ramos de Oliveira2; Stephany Miranda de Souza Mattos2
DOI:10.31365/issn.2595-1769.v23i3p87-95
1. Pontifícia Universidade Católica do Paraná (PUCPR), Programa de Pós-Graduação em Tecnologia em Saúde - Curitiba - Paraná - Brasil
2. Faculdade Herrero, Curso de Enfermagem - Curitiba - Paraná - Brasil
Endereço para correspondência:
Recebido em: 08/04/2023
Aprovado em: 25/06/2023
Resumo
INTRODUÇÃO: A epilepsia é uma doença com múltiplas repercussões para o indivíduo, sistemas de saúde e sociedade. Casos de epilepsia refratária ou fármaco-resistente, como West, síndrome de Lennox-Gastaut e a síndrome de Dravet são frequentemente observados em crianças, afetando seu desenvolvimento e qualidade de vida.
OBJETIVO: Identificar, na literatura científica internacional, as evidências clínicas sobre o uso do canabidiol para o tratamento primário ou adjuvante das encefalopatias epilépticas fármaco-resistentes, considerando seus benefícios e efeitos adversos.
MÉTODO: Scoping review fundamentada nas diretrizes do Joanna Briggs Institute. A busca sistemática foi conduzida nos bancos de dados Medline e CINAHL.
RESULTADOS: Foram incluídos 12 estudos relevantes que utilizaram o CBD enquanto terapia principal ou tratamento adjuvante das formas refratárias de epilepsia infantil.
Considerações Finais: As evidências cumulativas sugerem a segurança e eficácia do uso clínico do canabidiol como terapia para encefalopatia epiléptica refratária pediátrica, proporcionando redução na frequência das crises convulsivas e aumento na resposta ao tratamento convencional.
Palavras-chave: Epilepsia Fármaco-Resistente. Canabidiol. Tratamento Farmacológico. Prática Clínica Baseada em Evidências.
Abstract
INTRODUCTION: Epilepsy is a disease with multiple repercussions for the individual, health systems and society. Cases of refractory or drug-resistant epilepsy such as West, Lennox-Gastaut syndrome and Dravet syndrome are frequently observed in children, affecting their development and quality of life.
OBJECTIVE: To identify, in the international scientific literature, the clinical evidence on the use of cannabidiol for the primary or adjuvant treatment of drug-resistant epileptic encephalopathies, considering its benefits and adverse effects.
METHOD: Scoping review based on Joanna Briggs Institute guidelines. A systematic search was conducted in the Medline and CINAHL database.
RESULTS: Twelve relevant studies were included that used CBD as the main therapy or adjunct treatment of refractory forms of childhood epilepsy.
FINAL CONSIDERATIONS: Cumulative evidence suggests the safety and efficacy of the clinical use of cannabidiol as an therapy for pediatric refractory epileptic encephalopathy, providing a reduction in the frequency of seizures and an increase in the response to conventional treatment.
Keywords: Drug Resistant Epilepsy. Cannabidiol. Drug Therapy. Evidence-Based Practice.
INTRODUÇÃO
A epilepsia é uma desordem crônica do cérebro caracterizada por convulsões recorrentes e de consequências neurológicas, psiquiátricas e significativas.1 Na infância, a epilepsia é um dos distúrbios neurológicos mais comuns encontrados na prática clínica pediátrica2. Globalmente, a taxa de incidência de epilepsia na infância (1-12 meses de idade) é de 144 por 100.000 pessoas-ano e 58 casos por 100.000 crianças entre 1-10 anos.3
A International League Against Epilepsy (ILAE) define a epilepsia como um distúrbio cerebral caracterizado por uma predisposição permanente para gerar atividade elétrica anormal, denominada crises epilépticas, e pelas consequências neurobiológicas, cognitivas, psicológicas e sociais que carregam tal condição.4
Medicamentos anticonvulsivantes são a base para o tratamento de distúrbios convulsivos. Atualmente, duas gerações de medicamentos são utilizadas. A primeira é representada por drogas como Valproato, Carbamazepina, Fenitoína e Fenobarbital. A nova geração é representada por Lamotrigina, Oxcarbazepina, Topiramato, Clonazepam, Vigabatrina, Pregabalina, Rufinamida e Lacosamida.5
As drogas utilizadas para o tratamento da epilepsia (monoterapia ou em combinações) são eficazes para cerca de 70% dos casos. Consequentemente, 30% das pessoas com esta condição não têm controle efetivo de suas crises ou não toleram os fármacos antiepilépticos e possuem convulsões refratárias. Este quadro é denominado de epilepsia fármaco-resistente.6 A epilepsia fármaco-resistente é definida como a incapacidade de ficar livre de crises de modo sustentado após duas tentativas com fármacos antiepilépticos tolerados, apropriadamente selecionados e utilizados de modo adequado, seja como monoterapia ou em combinação.7
Algumas síndromes epilépticas infantis, como a síndrome de West, a síndrome de Lennox-Gastaut e a síndrome de Dravet são consideradas doenças refratárias aos tratamentos farmacológicos convencionais.8,9 As formas graves ou refratárias de epilepsia durante a infância são observadas, sobretudo, em substratos sociais que vivem em piores condições socioeconômicas e com menor acesso aos serviços de saúde.10 Pacientes com crises resistentes ao tratamento correm um risco elevado de sofrer danos cerebrais persistentes causados diretamente pelas crises, ou indiretamente, devido às consequências secundárias das crises epilépticas, com efeitos adversos na qualidade de vida.11
Frente à refratariedade das estratégias farmacológicas disponíveis, observa-se o crescimento da utilização de terapias alternativas para o controle da epilepsia, dentre as quais se destacam os canabinoides.
A cannabis é uma substância farmacologicamente complexa que contém mais de 400 entidades químicas e pelo menos 144 compostos canabinoides.12 Os principais compostos canabinoides de interesse no tratamento da epilepsia incluem Δ9-tetrahidrocanabinol (Δ9-THC), canabidiol (CBD), Δ9- tetrahidrocanabivarina (Δ9-THCV), canabidivarina (CBDV) e ácido Δ9- tetrahidrocanabinólico (Δ9-THCA).13 Os dois principais canabinoides que são investigados cientificamente para uso medicinal são o THC e o CBD, tendo sido o segundo recentemente aprovado para o tratamento de epilepsias refratárias da infância.14,15
Relatos de ensaios controlados, randomizados e controlados por placebo provaram a eficácia do CBD de grau farmacêutico no tratamento da epilepsia, levando, assim, à aprovação do medicamento pela Food and Drug Administration, dos Estados Unidos, e pela European Medicines Agency, para o tratamento de convulsões nas síndromes de Dravet e Lennox Gastaut.16 Adicionalmente, o National Institute for Health and Care Excellence (NICE) publicou uma guideline contendo recomendações sobre a adoção do CBD como uma alternativa de tratamento das epilepsias graves em crianças.17
Frente ao exposto, o objetivo do presente estudo é identificar, na literatura científica internacional, as evidências clínicas sobre o uso do canabidiol para o tratamento primário ou adjuvante das encefalopatias epilépticas fármaco-resistentes, considerando seus benefícios e efeitos adversos.
METODOLOGIA
Trata-se de uma scoping review baseada nas recomendações do - JBI Manual for Evidence Synthesis: Chapter 11: Scoping Reviews, do Joanna Briggs Institute.18 A revisão de escopo tem o intuito de abordar tópicos amplos, enfocando resultados abrangentes e aprofundados de estudos científicos, permitindo uma avaliação de evidências emergentes, fornecendo assim bases significativas para pesquisas futuras. Também permite identificar, examinar e sistematizar de forma rígida e efetiva um conceito ou características particulares ao identificar a natureza de um amplo campo do conhecimento.
Essa metodologia contempla cinco etapas: 1) elaboração da questão de pesquisa; 2) identificação de estudos relevantes; 3) seleção de estudos para revisão; 4) mapeamento dos dados; e 5) coleta, resumo e relato dos resultados.
A pesquisa foi orientada pela seguinte questão: quais são as evidências disponíveis sobre a eficácia e segurança do canabidiol enquanto alternativa de tratamento ou terapia adjuvante das encefalopatias epilépticas fármaco-resistentes pediátricas?
A busca sistemática por estudos relevantes foi conduzida entre abril e setembro de 2022, nas bases de dados National Library of Medicine (NLM) e Cumulative Index to Nursing and Allied Health Literature (CINAHL). Como critérios de inclusão, foram considerados artigos publicados na íntegra, no idioma inglês, publicados entre 2017 e 2022 e que apresentassem correlação com o objetivo proposto.
A construção do referencial teórico baseou-se na integração dos seguintes MESH terms: ("Drug-resistant epilepsy" OR "Epilepsy") AND ("Cannabidiol" OR "Cannabis") AND ("Treatment" OR "Therapeutics").
Complementarmente, adotou-se a categorização de Melnyk e Fineout-Overholt, para priorização de inclusão de estudos com base na qualidade das evidências: 1 - revisão sistemática, metanálise ou diretrizes clínicas embasadas em revisões sistemáticas de ensaios clínicos randomizados; 2 - ensaio clínico randomizado controlado; 3 - ensaios clínicos bem delineados sem aleatorização; 4 - estudo de coorte e/ou de caso-controle; 5 - evidências apresentadas de revisão sistemática, de estudos descritivos e qualitativos; 6 - evidências obtidas a partir de um único estudo descritivo ou qualitativo; 7 - opinião de autoridades e/ou parecer de comissão de especialistas.19
A partir da lista de estudos selecionados, cada manuscrito passou pelo crivo dos dois revisores, que aplicaram os critérios de elegibilidade e procederam à extração de dados qualitativos (autores, ano de publicação, periódico) e os dados clínicos (características dos estudos, principais resultados, incluindo efeitos adversos). Os dados obtidos foram organizados para apresentação em uma síntese narrativa.
Declara-se não haver fontes de fomento ou conflitos de interesse que influenciem na condução da presente revisão.
RESULTADOS
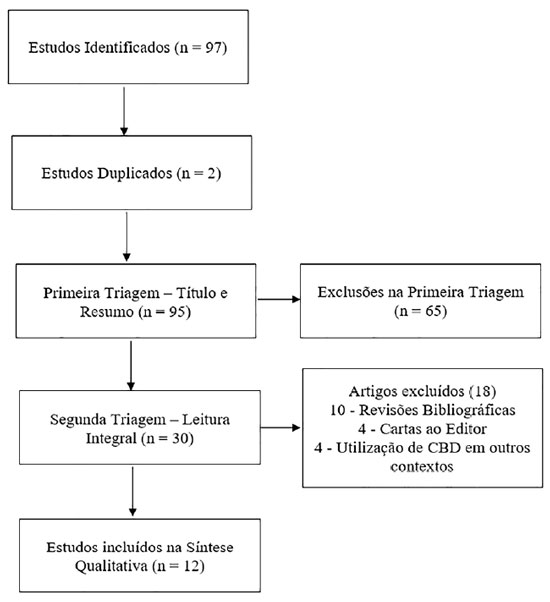
A estratégia de busca resultou em um total de 97 estudos relevantes, dos quais 12 preencheram os critérios de elegibilidade e foram incluídos na síntese qualitativa. (Figura 1).
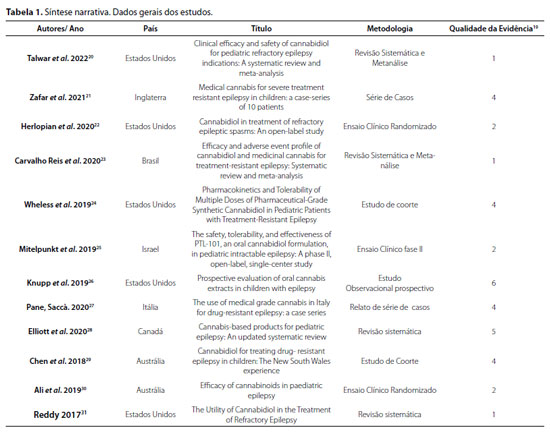
Os artigos incluídos encontram-se sumarizados nas Tabelas 1 e 2. A síntese narrativa sustenta as unidades de análise da discussão.
DISCUSSÃO
A epilepsia, bem como os efeitos colaterais dos anticonvulsivantes, comorbidades e consequências sociais das convulsões, levam a uma perda significativa na qualidade de vida das pessoas afetadas.16,32,33 Nesse contexto, buscamos identificar, na literatura científica internacional, as evidências clínicas do canabidiol para o tratamento das crises epilépticas fármaco-resistentes, descrevendo os efeitos colaterais, perfil de segurança e benefícios terapêuticos. A discussão foi estruturada, portanto, em dois eixos temáticos. Complementarmente, inclui-se a utilização de outras intervenções não farmacológicas para o tratamento das epilepsias pediátricas fármaco-resistentes.
Benefícios clínicos
Resultados variados para redução da frequência de convulsões foram documentados entre os estudos, destacando-se a evidência obtida a partir do resultado de revisões sistemáticas20,23,28,31 e ensaios clínicos randomizados.22,25,30 e séries de casos21,27.
Após a síntese dos resultados, evidenciou-se que a utilização de CBD como terapia adjuvante ou primeira linha proporcionou redução significativa da ocorrência e tempo das crises convulsivas. O tempo médio de resposta ao tratamento com CBD é de no mínimo 14 dias, chegando ao máximo de 5 meses.20,24,25,28 Além da redução da ocorrência de crises, desfechos secundários importantes são: a redução do tempo e intensidade das crises convulsivas, redução da quantidade de anticonvulsivantes consumidos, aumento da resposta ao tratamento e melhoras no domínio cognitivo e comportamental.21,22,28 Alguns casos relataram ainda, melhora no humor e na qualidade do sono e bem-estar geral sem.24 Adicionalmente, o CBD pode exercer efeitos aditivos ou sinérgicos significativos com drogas antiepilépticas.31
Uma revisão sistemática de ensaios clínicos randomizados envolvendo pacientes que receberam CBD oral altamente purificado (Epidiolex, 10 a 50 mg/kg/dia) por até 16 semanas avaliou a redução na frequência de convulsões e ocorrência de eventos adversos e interações com clobazam como co-terapia. Foram incluídos seis estudos com uma população total de 972 indivíduos. Os resultados evidenciaram que o CBD é altamente eficaz tanto como terapia autônoma quanto como terapia adjuvante com clobazam para controlar convulsões em condições de SD e LGS, ao mesmo tempo que limita os efeitos colaterais.20 Esses achados são corroborados pelos resultados de estudos similares que avaliaram os benefícios e perfil de segurança da intervenção, independentemente da etiologia das síndromes epilépticas.23,31
Uma série de casos relatou os benefícios do CBD em diversas crianças com síndromes epilépticas refratárias. Em um dos casos relatados, uma criança de cinco anos, com diagnóstico de síndrome de Dravet, apresentava mais de 50 crises tônico-clônicas generalizadas diárias. Após um tratamento de três meses com extrato de cannabis e alto teor de CBD, houve redução de mais de 90% de suas crises. Além do controle das convulsões, melhoras no sono e no humor foram observadas.34 Estes resultados são corroborados por estudos similares que adotaram a intervenção terapêutica.27.
O CBD administrado em pacientes com diagnóstico de síndrome de Lennox-Gastaut e Dravet demonstrou resultados importantes na redução e na frequência das crises em comparação com o placebo e as drogas antiepilépticas usuais.35 Em geral, o CBD adjuvante é geralmente seguro e eficaz para convulsões resistentes ao tratamento em crianças com epilepsia de início precoce grave.27,36,37 Logo, seu uso pode ser recomendado como terapia adjuvante em pacientes com dois anos de idade ou mais.38,39
Outra questão relevante diz respeito à duração dos tratamentos, necessitando de mais estudos que observem a resposta no longo prazo.28 Um estudo retrospectivo com 54 pacientes que receberam CBD demonstrou que o medicamento é seguro e bem tolerado para uso em longo prazo (60 meses). Os desfechos primários avaliados foram o controle e a redução das crises convulsivas e a redução da dose de anticonvulsivantes de primeira linha.40
Em estudo similar que avaliou a segurança e eficácia de longo prazo do canabidiol em pacientes adultos e pediátricos por um tempo de segmento de dois anos, identificaram-se controle das crises convulsivas em termos de frequência e gravidade, boa tolerabilidade e baixa ocorrência de efeitos adversos. Em comparação às crianças, os pacientes adultos apresentaram menor gravidade das crises convulsivas.41
Estudo conduzido na Argentina avaliou a tolerabilidade e segurança do CBD em crianças com formas graves de epilepsia. O canabidiol mostrou boa eficácia, com uma redução ≥ 50% na frequência das crises em 73,5% dos pacientes. A frequência média mensal de crises foi reduzida de 959 para 381 (diminuição da mediana de 299 para 102, p <0,001). Todos os efeitos adversos foram leves ou moderados. O efeito adverso mais comum foi sonolência (32%), geralmente revertida pelo ajuste da dose de Clobazam.42
Em crianças, a posologia inicial recomendada é de 2,5 mg/ kg, sendo administrada duas vezes ao dia (máximo de 5 mg/ kg/ dia). Após sete dias, a dosagem pode ser aumentada para 5 mg/ kg, duas vezes ao dia (máximo de 10 mg/kg/dia). Semanalmente, pode ser aumentada para uma dosagem máxima diária de 20 mg/ kg, duas vezes ao dia, observando-se a reação e a tolerabilidade dos pacientes aos efeitos adversos.38
Efeitos adversos
Estudos de CBD para tratamento de epilepsia e distúrbios psiquiátricos em humanos relataram interações medicamentosas induzidas pelo medicamento, alterações hepáticas, sonolência e distúrbios gastrointestinais, tais como diminuição do apetite, náuseas, vômitos e diarreia.37,39,43,44 Esses achados são compatíveis com os eventos adversos relatados nos estudos incluídos.29 Adicionalmente, em um dos casos citados, houve agravamento na frequência das crises convulsivas.26 Geralmente, esses efeitos adversos são leves ou moderados e transitórios.45 Cabe ressaltar que o monitoramento das alterações na função hepática e a conscientização sobre possíveis interações medicamentosas são essenciais.29.
Um ensaio de generalização avaliou a segurança no longo prazo e a eficácia anticonvulsivante do CBD. Efeitos adversos foram relatados em 96% dos pacientes, sendo os casos graves relatados em 42% dos pacientes, dentre os quais 12% foram descontinuados. Os efeitos adversos comuns foram convulsão (39%), diarreia (38%), pirexia (34%) e sonolência (29%). Cinquenta e cinco (15%) pacientes apresentaram transaminase hepática elevada (níveis superiores a três vezes o limite superior do normal), incluindo 40 (73%) pacientes em uso concomitante de ácido valproico.46
A elevação da transaminase é o efeito adverso mais comum que leva à descontinuação do CBD. A coadministração com valproato de sódio pode aumentar o risco de hepatotoxicidade.16,38 Esses efeitos adversos foram reportados em uma metanálise, na qual 87,9% e 72,2% dos pacientes tratados com CBD e placebo experimentaram efeitos adversos, resultando na descontinuação do tratamento em 8,9% e 1,8% nos grupos de tratamento e controle, respectivamente.35
O CBD é um inibidor poderoso das enzimas hepáticas CYP450, CYP3A4 e CYP2C19, resultando em redução da metabolização dos medicamentos de uso de primeira linha, como Clobazam e Valproato de Sódio, em duas a sete vezes. Como resultado, observa-se um efeito sedativo importante, comumente citado nos estudos experimentais. Em contrapartida, quando utilizado como droga de primeira linha, sem associação com outros medicamentos, mesmo que em doses muito altas, essa sedação não é observada, indicando que se utilizado isoladamente, o CBD não interfere no estado de alerta do paciente.47
Os dados oriundos de ensaios clínicos sintetizados em uma revisão sistemática sugerem que o CBD é bem tolerado e tem relativamente poucos efeitos adversos graves; no entanto, as interações com outros medicamentos devem ser monitoradas cuidadosamente.47
Cabe salientar que pacientes com crises resistentes sofrem frequentemente de vários tipos de convulsões, necessitando de estratégias de polifarmácia que combinam diferentes drogas antiepilépticas. Embora essa abordagem possa fornecer algum grau de controle dos episódios convulsivos, os pacientes também apresentam efeitos colaterais significativos, incluindo sedação, sonolência e impactos comportamentais e cognitivos. Além disso, esses pacientes experimentam uma alta carga de convulsões tônico-clônicas generalizadas associadas a um risco aumentado de morte súbita inesperada na epilepsia.48,49
Terapias alternativas não-farmacológicas
Apesar da relevância do CBD para o tratamento das epilepsias pediátricas, sua utilização ainda é incipiente e o custo de tratamento permanece elevado. Nesse contexto, algumas alternativas de intervenções não farmacológicas podem contribuir para o suporte clínico de crianças com epilepsia resistente a medicamentos, destacando-se a dieta cetogênica, o marca-passo (estimulação do nervo vago) e a administração de imunoglobulinas intravenosas.
Evidências obtidas a partir de metanálise de ensaios clínicos randomizados demonstram o controle efetivo dos episódios de crises convulsivas ou pelo menos 50% de redução das convulsões em 48,31% dos pacientes no grupo de intervenção (dieta cetogênica).50 Como a maioria dos pacientes em dieta cetogênica também está recebendo medicamentos anticonvulsivantes, muitas vezes surgem dúvidas sobre sua combinação. Essa intervenção normalmente é implementada como um complemento, e não como um substituto para os medicamentos. Os óleos CBD geralmente são feitos sem açúcar ou carboidratos e, portanto, podem ser usados em combinação com dieta cetogênica. O uso combinado das duas intervenções parece potencializar os benefícios isolados.51
Em pacientes com epilepsia resistente a medicamentos que não respondem aos tratamentos etiológicos (por exemplo, ressecção de lesões para etiologias estruturais, imunoterapia para etiologias autoimunes), uma dieta cetogênica ou neuromodulação (por exemplo, estimulação do nervo vago) é considerada uma terapia alternativa.52
A estimulação do nervo vago representa uma alternativa eficaz para reduzir convulsões em pacientes que não desejam se submeter a cirurgia craniana ou ablação térmica intersticial a laser, que tiveram cirurgia malsucedida ou não são elegíveis para procedimento cirúrgico (incluindo indivíduos com deficiência intelectual que podem ser incapazes de entender o consentimento para um procedimento irreversível).53 No entanto, evidências clínicas robustas para quantificar a diferença da eficácia e segurança do tratamento nessa população específica de pacientes ainda precisam ser relatadas.54
No que se refere ao uso de imunoglobulinas (IgG) intravenosas, sua utilização apresenta implicações clínicas relevantes, uma vez que muitos pacientes apresentam baixos níveis séricos dessa substância. No entanto, uma revisão sistemática Cochrane não comprovou os benefícios desta intervenção para os desfechos: frequência e duração das convulsões, qualidade de vida e efeitos adversos quando usados como monoterapia ou como tratamento adicional para pessoas com epilepsia. A qualidade da evidência foi considerada baixa e os resultados, inclonclusivos.55
CONSIDERAÇÕES FINAIS
As evidências cumulativas obtidas, a partir de estudos bem delineados, sugerem a segurança, tolerabilidade e eficácia de longo prazo do uso clínico do canabidiol para diferentes formas de encefalopatia epiléptica refratária pediátrica, resultando em benefícios na qualidade de vida dos pacientes por meio da redução na frequência das crises convulsivas e aumento na resposta ao tratamento convencional.
Complementa-se que o CBD, enquanto terapia adjuvante ou tratamento de primeira linha para a epilepsia infantil fármaco-resistente, sobretudo nas síndromes de Dravet e Lennox-Gastaut, apresenta menor ocorrência de efeitos adversos do que quando utilizado como terapia complementar. Sua utilização pode ser combinada à adoção de dieta cetogência.
O uso protocolar do CBD ainda carece do desenvolvimento de diretrizes clínicas baseadas em evidências que elaborem um consenso das indicações do medicamento para o tratamento protocolar da epilepsia infantil fármaco-resistente.
REFERÊNCIAS
1. Beghi E, Giussani G. Aging and the Epidemiology of Epilepsy. Neuroepidemiology. 2018;51(3-4):216-223.
2. Mammas IN, Spandidos DA. The challenge of paediatric epilepsy nursing: An interview with Mrs. Jenny O'Brien, paediatric epilepsy nursing specialist at the Wirral University Teaching Hospital, UK. Exp Ther Med. 2020;20(6):295.
3. Aaberg KM, Gunnes N, Bakken IJ, Lund Søraas C, Berntsen A, Magnus P, et al. Incidence and Prevalence of Childhood Epilepsy: A Nationwide Cohort Study. Pediatrics. 2017;139(5):e20163908.
4. Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia. 2014;55(4):475-82.
5. Chen B, Choi H, Hirsch LJ, Katz A, Legge A, Buchsbaum R, et al. Psychiatric and behavioral side effects of antiepileptic drugs in adults with epilepsy. Epilepsy Behav. 2017;76:24-31.
6. Sheng J, Liu S, Qin H, Li B, Zhang X. Drug-Resistant Epilepsy and Surgery. Curr Neuropharmacol. 2018;16(1):17-28.
7. Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia. 2010;51(6):1069-77.
8. Xue-Ping W, Hai-Jiao W, Li-Na Z, Xu D, Ling L. Risk factors for drug-resistant epilepsy. A systematic review and meta-analysis. Medicine (Baltimore). 2019;98(30):e16402.
9. Miller I, Scheffer IE, Gunning B, Sanchez-Carpintero R, Gil-Nagel A, Perry MS, et al. GWPCARE2 Study Group. Dose-Ranging Effect of Adjunctive Oral Cannabidiol vs Placebo on Convulsive Seizure Frequency in Dravet Syndrome: A Randomized Clinical Trial. JAMA Neurol. 2020;77(5):613-621.
10. Gutiérrez MZ, Nasser E, Castellanos N, Romero K, Lobo F, Paz K, et al. Características clínicas y sociodemográficas de pacientes con epilepsia en un hospital pediátrico en Honduras. Rev Méd Hondur, 2022;90(1):1-94.
11. Ngampoopun M, Nabangchang C, Suwanpakdee P. Survey of local cannabidiol use in parents of children with epilepsy in Thailand: the prevalence, perceptions, and knowledge. J Cannabis Res. 2022;4(1):43.
12. Hanus LO, Meyer SM, Muñoz E, Taglialatela-Scafati O, Appendino G. Phytocannabinoids: a unified critical inventory. Nat Prod Rep. 2016;33(12):1357-1392.
13. Gaston TE, Friedman D. Pharmacology of cannabinoids in the treatment of epilepsy. Epilepsy Behav. 2017;70(Pt B):313-318.
14. Abu-Sawwa R, Scutt B, Park Y. Emerging Use of Epidiolex (Cannabidiol) in Epilepsy. J Pediatr Pharmacol Ther. 2020;25(6):485-499.
15. Schlag AK, Zafar R, Nutt D. Medical cannabis and epilepsy in the UK - A qualitative analysis of the carers' perspective: "We're asking for quality of life for our children". Drug Science, Policy and Law. 2021;7:20503245211034930.
16. von Wrede R, Helmstaedter C, Surges R. Cannabidiol in the Treatment of Epilepsy. Clin Drug Investig. 2021;41(3):211-220.
17. NICE (2019) NICE Guideline [NG 144]. Cannabis-based medicinal products. Published November 11th 2019. Availale from: https://www.nice.org.uk/guidance/ng144 (accessed 13 August 2022).
18. Peters MDJ, Godfrey C, McInerney P, Munn Z, Tricco AC, Khalil, H. Chapter 11: Scoping Reviews (2020 version). In: Aromataris E, Munn Z (Editors). JBI Manual for Evidence Synthesis, JBI, 2020. Available from: https://synthesismanual.jbi.global
19. Fineout-Overholt E, Melnyk BM, Stillwell SB, Williamson KM. Evidence-based practice, step by step: Critical appraisal of the evidence: part III. Am. J. Nurs. 2010;110(11):43-51.
20. Talwar A, Estes E, Aparasu R, Reddy DS. Clinical efficacy and safety of cannabidiol for pediatric refractory epilepsy indications: A systematic review and meta-analysis. Exp Neurol. 2022;359:114238.
21. Zafar R, Schlag A, Phillips L, Nutt DJ. Medical cannabis for severe treatment resistant epilepsy in children: a case-series of 10 patients. BMJ Paediatr Open. 2021;5(1):e001234.
22. Herlopian A, Hess EJ, Barnett J, Geffrey AL, Pollack SF, Skirvin L, Bruno P, Sourbron J, Thiele EA. Cannabidiol in treatment of refractory epileptic spasms: An open-label study. Epilepsy Behav. 2020;106:106988.
23. Carvalho Reis R, Almeida KJ, da Silva Lopes L, de Melo Mendes CM, Bor-Seng-Shu E. Efficacy and adverse event profile of cannabidiol and medicinal cannabis for treatment-resistant epilepsy: Systematic review and meta-analysis. Epilepsy Behav. 2020;102:106635.
24. Wheless JW, Dlugos D, Miller I, Oh DA, Parikh N, Phillips S, et al; INS011-14-029 Study Investigators. Pharmacokinetics and Tolerability of Multiple Doses of Pharmaceutical-Grade Synthetic Cannabidiol in Pediatric Patients with Treatment-Resistant Epilepsy. CNS Drugs. 2019;33(6):593-604.
25. Mitelpunkt A, Kramer U, Hausman Kedem M, Zilbershot Fink E, Orbach R, Chernuha V, et al. The safety, tolerability, and effectiveness of PTL-101, an oral cannabidiol formulation, in pediatric intractable epilepsy: A phase II, open-label, single-center study. Epilepsy Behav. 2019;98(Pt A):233-237.
26. Knupp KG, Rice JD, Helmkamp LJ, Galinkin J, Sempio C, Jost K, Chapman KE. Prospective evaluation of oral cannabis extracts in children with epilepsy. Seizure. 2019;72:23-27. Pane C, Saccà F. The use of medical grade cannabis in Italy for drug-resistant epilepsy: a case series. Neurol Sci. 2020;41(3):695-6.
28. Elliott J, DeJean D, Clifford T, Coyle D, Potter BK, Skidmore B, et al. Cannabis-based products for pediatric epilepsy: An updated systematic review. Seizure. 2020;75:18-22.
29. Chen KA, Farrar M, Cardamone M, Gill D, Smith R, Cowell CT, et al. Cannabidiol for treating drug-resistant epilepsy in children: the New South Wales experience. Med J Aust. 2018;209(5):217-221.
30. Ali S, Scheffer IE, Sadleir LG. Efficacy of cannabinoids in paediatric epilepsy. Dev Med Child Neurol. 2019;61(1):13-18.
31. Reddy DS. The Utility of Cannabidiol in the Treatment of Refractory Epilepsy. Clin Pharmacol Ther. 2017;101(2):182-184.
32. Orozco-Hernández JP, Quintero-Moreno JF, Marín-Medina DS, Castaño-Montoya JP, Hernández-Coral P, Pineda M, et al. Clinical and sociodemographic profile of epilepsy in adults from a reference center in Colombia. Neurologia (Engl Ed). 2019;34(7):437-444.
33. Caraballo R, Reyes G, Demirdjian G, Huaman M, Gutierrez R. Long-term use of cannabidiol-enriched medical cannabis in a prospective cohort of children with drug-resistant developmental and epileptic encephalopathy. Seizure. 2022;95:56-63.
34. Raucci U, Pietrafusa N, Paolino MC, Di Nardo G, Villa MP, Pavone P, et al. Cannabidiol Treatment for Refractory Epilepsies in Pediatrics. Front Pharmacol. 2020;11:586110.
35. Lattanzi S, Brigo F, Trinka E, Zaccara G, Cagnetti C, Del Giovane C, et al. Efficacy and Safety of Cannabidiol in Epilepsy: A Systematic Review and Meta-Analysis. Drugs. 2018;78(17):1791-1804.
36. Golub V, Reddy DS. Cannabidiol Therapy for Refractory Epilepsy and Seizure Disorders. Adv Exp Med Biol. 2021;1264:93-110.
37. Treves N, Mor N, Allegaert K, Bassalov H, Berkovitch M, Stolar OE, et al. Efficacy and safety of medical cannabinoids in children: a systematic review and meta-analysis. Sci Rep. 2021;11(1):23462.
38. Silva GD, Del Guerra FB, de Oliveira Lelis M, Pinto LF. Cannabidiol in the Treatment of Epilepsy: A Focused Review of Evidence and Gaps. Front Neurol. 2020;11:531939.
39. Huestis MA, Solimini R, Pichini S, Pacifici R, Carlier J, Busardò FP. Cannabidiol Adverse Effects and Toxicity. Curr Neuropharmacol. 2019;17(10):974-989.
40. Patel S, Grinspoon R, Fleming B, Skirvin LA, Wade C, Wolper E, et al. The long-term efficacy of cannabidiol in the treatment of refractory epilepsy. Epilepsia. 2021;62(7):1594-1603.
41. Gaston TE, Ampah SB, Martina Bebin E, Grayson LP, Cutter GR, Hernando K, et al; UAB CBD Program. Long-term safety and efficacy of highly purified cannabidiol for treatment refractory epilepsy. Epilepsy Behav. 2021;117:107862.
42. Caraballo R, Demirdjian G, Reyes G, Huaman M, Gutierrez R. Effectiveness of cannabidiol in a prospective cohort of children with drug-resistant epileptic encephalopathy in Argentina. Seizure. 2020;80:75-80.
43. Devinsky O, Marsh E, Friedman D, Thiele E, Laux L, Sullivan J, et al. Cannabidiol in patients with treatment-resistant epilepsy: an open-label interventional trial. Lancet Neurol. 2016;15:270-278.
44. Lattanzi S, Trinka E, Striano P, Rocchi C, Salvemini S, Silvestrini M, et al. Highly Purified Cannabidiol for Epilepsy Treatment: A Systematic Review of Epileptic Conditions Beyond Dravet Syndrome and Lennox-Gastaut Syndrome. CNS Drugs. 2021;35(3):265-281.
45. Moreira GA, Moraes Nero R, Ribeiro RG, Crippa ACS. Cannabidiol for the treatment of refractory epilepsy in children: a critical review of the literature. Rev Paul Pediatr. 2022;41:e2021197.
46. Patel AD, Mazurkiewicz-Bełdzińska M, Chin RF, Gil-Nagel A, Gunning B, Halford JJ, et al. Long-term safety and efficacy of add-on cannabidiol in patients with Lennox-Gastaut syndrome: Results of a long-term open-label extension trial. Epilepsia. 2021;62(9):2228-2239.
47. Chesney E, Oliver D, Green A, Sovi S, Wilson J, Englund A, et al. Adverse effects of cannabidiol: a systematic review and meta-analysis of randomized clinical trials. Neuropsychopharmacology. 2020;45(11):1799-1806.
48. Verducci C, Hussain F, Donner E, Moseley BD, Buchhalter J, Hesdorffer D, et al. SUDEP in the North American SUDEP Registry: The full spectrum of epilepsies. Neurology. 2019;93(3):e227-e236.
49. Malaca S, Busardò FP, Nittari G, Sirignano A, Ricci G. Fourth Generation of Synthetic Cannabinoid Receptor Agonists: A Review on the Latest Insights. Curr Pharm Des. 2022;28(32):2603-2617.
50. Pizzo F, Collotta AD, Di Nora A, Costanza G, Ruggieri M, Falsaperla R. Ketogenic diet in pediatric seizures: a randomized controlled trial review and meta-analysis. Expert Rev Neurother. 2022;22(2):169-177.
51. Armeno ML, Kossoff EH. Let food be thy medicine. The interaction between ketogenic diet therapy and anti-seizure medications: A systematic review. Epileptic Disord. 2023;25(1):18-27.
52. Xie H, Ma J, Ji T, Liu Q, Cai L, Wu Y. Vagus nerve stimulation in children with drug-resistant epilepsy of monogenic etiology. Front. Neurol. 2022;13:951850.
53. Batson S, Shankar R, Conry J, Boggs J, Radtke R, Mitchell S et al. Efficacy and safety of VNS therapy or continued medication management for treatment of adults with drug-resistant epilepsy: systematic review and meta-analysis. J Neurol. 2022;269:2874-2891.
54. Ji T, Yang Z, Liu Q, Liao J, Yin F, Chen Y et al. Vagus nerve stimulation for pediatric patients with intractable epilepsy between 3 and 6 years of age: study protocol for a double-blind, randomized control trial. Trials. 2019;20(1):44.
55. Geng J, Dong J, Li Y, Ni H, Jiang K, Shi LL, Wang G. Intravenous immunoglobulins for epilepsy. Cochrane Database Syst Rev. 2017;7(7):CD008557.