Número atual: 20(1) - Março 2020
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Relato de Caso
Hipoglicemia secundária a hiperinsulinismo congênito: importância do diagnóstico e propedêutica precoces
Secondary hypoglycemia and congenital hyperinsulinism: importance of early diagnosis and propedeutics
Paolla Dorneles Ferraz Sousa; Bruno Bastos Godoi; Beatriz Rebello de Sousa Benetton; Luiza Vilas Boas Freitas; Isabella Ferreira Brugiolo; Frederico da Silva Bitencourt; Marcio Ferreira Aguiar Junior; Marcela Danielle Pimenta de-Barros
DOI:10.31365/issn.2595-1769.v20i1p26-30
Universidade Federal dos Vales do Jequitinhonha e Mucuri, Faculdade de Medicina - Diamantina - Minas Gerais - Brasil
Endereço para correspondência:
Recebido em: 21/01/2020
Aprovado em: 22/01/2020
Instituição: Universidade Federal dos Vales do Jequitinhonha e Mucuri
Resumo
INTRODUÇÃO: A hipoglicemia secundária ao hiperinsulinismo é uma condição clínica genética de desordem da secreção da insulina. É a causa mais comum de hipoglicemia com baixa produção de corpos cetônicos em neonatos e no primeiro ano de vida e a principal causa de hiperinsulinismo persistente em menores de um ano, associado a um risco significativo de dano cerebral permanente.
OBJETIVO: Relatar um caso de hipoglicemia neonatal secundária a hiperinsulinismo congênito, a fim de demonstrar a importância do diagnóstico precoce e da terapêutica correta.
DESCRIÇÃO DO CASO: Recém-nascido, sexo feminino, nascida a termo (37 semanas e 1 dia) apresentando episódios frequentes de hipoglicemia. Realizada infusão de glicose intravenosa sem melhora significativa. Foram realizadas dosagens séricas de glicose, cortisol, hormônio de crescimento, insulina e gasometria venosa, e coletada urina para estudo de achados e sedimentos urinários, sendo firmado o diagnóstico de hipoglicemia secundária. Após os resultados dos exames realizados, foi confirmada a hipótese diagnóstica de hipoglicemia secundária a hiperinsulinismo e iniciada terapêutica com Diazóxido e Hidrocolorotiazida.
DISCUSSÃO: A hipoglicemia secundária a hiperinsulinismo congênito é uma patologia difícil de reconhecer devido aos sinais e sintomas serem muitas vezes inespecíficos. Assim, tornandose essencial a atenção ao neonato devido às graves consequências que tal quadro pode gerar, como danos cerebrais. O diagnóstico é feito a partir da avaliação clínica e dos achados laboratoriais que monstram a secreção inapropriada de insulina. Em relação ao tratamento, o principal medicamento utilizado é o diazóxido associado à hidroclorotiazida. Em alguns casos faz-se necessário o uso de octreotide.
Palavras-chave: Hipoglicemia; Hiperinsulinismo Congênito; Terapêutica; Diagnóstico.
Abstract
INTRODUCTION: Hypoglycemia secondary to hyperinsulinism is a genetic clinical condition of insulin secretion disorder. It is the most common cause of hypoglycemia with low ketone body production in neonates and in the first year of life, and the leading cause of persistent hyperinsulinism in children under one year, associated with a significant risk of permanent brain damage.
OBJECTIVE: To report a case of neonatal hypoglycemia secondary to congenital hyperinsulinism in order to demonstrate the importance of early diagnosis and correct therapy.
CASE DESCRIPTION: Newborn, female, full-term (37 weeks and 1 day) presenting with frequent episodes of hypoglycaemia. Intravenous glucose infusion without significant improvement. Serum dosages of glucose, cortisol, growth hormone, insulin and venous blood gas analysis were performed and urine collected to study urinary findings and sediments, and the diagnosis of secondary hypoglycemia was confirmed. After the results of the exams, the diagnostic hypothesis of hypoglycemia secondary to hyperinsulinism was confirmed, and diazoxide and hydrochlorothiazide therapy was initiated.
DISCUSSION: Hypoglycemia secondary to congenital hyperinsulinism is a pathology difficult to recognize because signs and symptoms are often nonspecific. Thus, attention to the newborn is essential due to the serious consequences that such issue can generate, such as brain damage. The diagnosis is made based on clinical evaluation and laboratory findings showing inappropriate insulin secretion. Regarding treatment, the main drug used is hydrochlorothiazide-associated diazoxide. In some cases, the use of octreotide is required.
Keywords: Hypoglycemia; Congenital Hyperinsulinism; Therapeutics; Diagnosis.
INTRODUÇÃO
A hipoglicemia é um distúrbio metabólico comum no período neonatal e deve ser avaliada a partir de um conjunto de fatores, como níveis baixos de glicemia, sinais clínicos (hiporexia, agitação ou letargia, convulsões, rebaixamento do nível de consciência, dentre outros) e desaparecimento dos sinais após correção dos níveis glicêmicos. Pode ser definida como níveis de glicemia capilar abaixo de 45 mg/dL ou níveis séricos abaixo de 40 mg/dL. Os principais fatores de risco são recém-nascidos de mãe diabética ou com hipotireoidismo, pequenos para idade gestacional, grandes para idade gestacional, pré- termos ou baixo peso ao nascer. Em geral, os pacientes costumam apresentar níveis inadequados de insulina sérica, devido à regulação prejudicada da secreção, processo fisiológico e de adaptação próprio da transição da vida intrauterina para extrauterina. Ao contrário dos casos de hipoglicemia secundária a hiperinsulinismo, esse quadro de hipoglicemia na maioria dos casos é transitório. Já no hiperinsulinismo a hipoglicemia tende a persistir no período neonatal 1-6.
A hipoglicemia secundária ao hiperinsulinismo é uma condição clínica genética de desordem da secreção da insulina. É a causa mais comum de hipoglicemia com baixa produção de corpos cetônicos em neonatos e no primeiro ano de vida e a principal causa de hiperinsulinismo persistente em menores de um ano, associado a um risco significativo de dano cerebral permanente7.
Uma importante etiologia a ser citada é o hiperinsulinismo associado a hiperamonemia, também conhecido como hiperinsulinismo glutamato resistente. É causado por mutações ativadoras na GDH, uma enzima mitocondrial, e um regulador importante do metabolismo de aminoácidos e de amônia em células beta, fígado e cérebro. O quadro clínico de hipoglicemia se apresenta em episódios recorrentes em período pós-prandial, podendo ser precipitados por refeições ricas em proteínas 8-10.
Durante o período intrauterino o feto recebe glicose da placenta por meio da difusão facilitada. Após o nascimento, os neonatos sem fatores de risco para hipoglicemia apresentam uma queda dos níveis glicêmicos nas primeiras 24-48 horas 7. A transição pós-natal é garantida pela mobilização de respostas metabólicas e endócrinas com rápido aumento da secreção de catecolaminas e glucagon e diminuição nos níveis de insulina. Essas alterações hormonais induzem atividades enzimáticas que ativam os processos de glicogenólise, gliconeogênese, lipólise e cetogênese, que fornecem glicose endógena, ácidos graxos livres e corpos cetónicos. Estes últimos são usados como fontes alternativas de energia pelo cérebro 11.
Nessa fase da vida o tecido cerebral ainda é imaturo, devido à intensa atividade metabólica e extremamente ávido por glicose, sendo bastante vulnerável às reduções de níveis glicêmicos mesmo que em episódios breves. Sendo assim, a ocorrência de episódios de hipoglicemia repetidos podem gerar danos cerebrais, em grande parte das vezes graves e irreversíveis 11-13.
Neste panorama, o aumento da concentração de insulina inibe a produção endógena de glicose, bloqueando a glicólise e a neoglicogênese 14-16. Por causa desse bloqueio, não ocorre produção de corpos cetônicos, o que serviria de substrato energético alternativo para o tecido cerebral. Por outro lado, o efeito anabólico da insulina, que implica em estímulo à lipogênese, inibe a liberação de ácidos graxos livres e a beta-oxidação 7,11. Níveis baixos de glicemia sérica associados à não produção de corpos cetônicos culminam em danos cerebrais 12.
Portanto, faz-se necessário o diagnóstico e a instituição da terapêutica imediatos, a fim de prevenir danos ao neurodesenvolvimento complicações como epilepsia. Dessa maneira, o presente artigo tem por objetivo relatar um caso de hipoglicemia neonatal secundária a hiperinsulinismo congênito, a fim de demonstrar a importância do processo diagnóstico precoce e da terapia precoces.
DESCRIÇÃO DO CASO
Recém-nascido (RN), sexo feminino, nascida a termo (37 semanas e 1 dia) de parto cesárea devido à hipertensão arterial materna, que gerou um estado fetal não tranquilizador, pequena para idade gestacional (PIG), baixo peso (BP): 2.045g e 45,4cm, Apgar 9 (1º minuto) e 10 (5º minuto). Diante do quadro de ser um RN PIG e com BP, foi instituída monitorização de glicêmica, a qual evidenciou episódios frequentes de hipoglicemia (tabela 1), ainda no alojamento compartilhado. Diante desse quadro, foi encaminhada à unidade de cuidados intermediários (UCI) no segundo dia de vida. Foi administrada soroterapia com suporte hídrico durante quatro dias com: soro fisiológico (SF) 0,9% a 80ml/kg; taxa de infusão de glicose (TIG) de 6mg/kg/ min, Gluconato de Cálcio 10% de 30ml. Além dos episódios de hipoglicemias, o RN apresentou icterícia neonatal tardia sem níveis de bilirrubina indicativos de fototerapia, sopro sistólico grau I/VI em borda esternal esquerda baixa sem irradiações e sem repercussões sistêmicas e monilíase perineal. Foi realizado o teste do pezinho sem alterações.
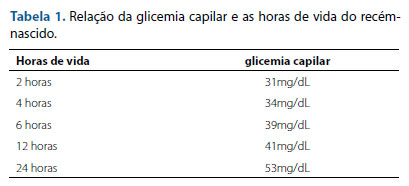
Foi estabelecida dieta com leite materno a livre demanda sendo administrado mediante mamadas ou por copo, entretanto ainda eram evidenciados episódios de hipoglicemia aleatórios e sem relação com o horário das mamadas. Com 17 dias de vida, ainda na persistência de hipoglicemias frequentes, foi instituída infusão contínua de soro glicosado hipertônico (SGH) 50% com TIG de 4mg/kg/min e suporte hídrico com SF 0,9% de 50ml/ kg. No dia seguinte, foi retirada da soroterapia e realizado jejum para coleta de exames para confirmação diagnóstica, sendo no sangue: glicemia, cortisol, hormônio do crescimento, insulina e gasometria; e na urina: estudo de achados e sedimentos urinários. É importante citar que, para o correto diagnóstico, tais exames foram coletados na vigência de hipoglicemia. Contudo, não foi aventada a possibilidade de hiperinsulinismo por hiperamonemia. Portanto, não foi solicitada dosagem sérica de amônia ou realizada mudança dietética relacionada ao teor proteico. Os resultados dos exames estão descritos na tabela 2:

Após resultados, foi firmado o diagnóstico de hipoglicemia secundária a hiperinsulinismo congênito. Sendo assim, iniciado tratamento de controle com diazóxido e hidroclorotiazida.
A terapia medicamentosa foi introduzida no 39° dia de vida da paciente na dose de 5mg/kg/dia do Diazóxido, 3 vezes ao dia, e 7mg/kg/dia da Hidroclorotiazida, 2 vezes ao dia. Concomitantemente à introdução da terapia, foi realizada a redução em 50% da soroterapia com infusão de glicose, evoluindo com boa resposta e sem episódio de hipoglicemias. No 40° dia de vida foi reduzida soroterapia em 50% novamente (alcançando uma infusão de glicose de 25% da taxa inicial), não sendo evidenciados novos episódio de hipoglicemia. Diante dos ótimos resultados de glicemia capilar e após redução da soroterapia, optou-se por suspender a infusão venosa de glicose e manter somente o tratamento com Diazóxido e Hidroclorotiazida. Paciente recebeu alta no 41° dia de vida, pesando 2.500g, em uso de Diazóxido (5mg por dose, 3 vezes ao dia) e Hidroclorotiazida (8,75mg por dose, 2 vezes ao dia), com encaminhamento ao endocrinologista pediátrico.
DISCUSSÃO
A Hipoglicemia Hiperinsulinêmica (HH) persistente, causada por excesso de secreção de insulina pelas células β-pancreáticas, possui diversas causas, podendo ser congênitas ou secundárias. As desordens congênitas são as mais comuns 12,17.
Em situação ideal, a glicose promove despolarização da membrana celular e estimula a liberação dos grânulos de insulina. Isso se dá por aumento do ATP através da glicólise e ciclo de Krebs que ativa na membrana celular o receptor de sulfoniluréia (SUR-1) que fecha e promove o aumento da concentração de potássio dentro da célula. Esse aumento leva a despolarização da membrana, abre os canais de cálcio dependentes da voltagem e eleva o cálcio intracelular, promovendo a saída dos grânulos de insulina 7,18.
Na maioria dos casos as causas congênitas estão associadas às modificações nos canais KATP presentes na membrana celular das células β-pancreáticas. As modificações mais comuns são as alterações nos genes codificadores das subunidades SUR-1 e Kir6.2 que causam uma despolarização contínua da membrana celular, o que gera a liberação contínua de grânulos de insulina 7,17. Devido ao excesso de insulina, os níveis glicêmicos ficam baixos por maior absorção da glicose pelo tecido adiposo e músculo esquelético.
A patologia é difícil de reconhecer devido aos frequentes sinais e sintomas inespecíficos. A clínica pode variar num espectro que vai de ausência de sintomas até quadro florido com sintomas adrenérgicos e adrenérgicos e por falta de glicose no tecido cerebral, como palidez, sudorese, calafrios, taquicardia, cefaleia, letargia, irritabilidade, agitação, dificuldade respiratória, apneia e convulsões. A atenção ao neonato é de extrema necessidade, tendo em vista que os sintomas são inespecíficos e que a persistência da hipoglicemia pode gerar danos cerebrais permanentes 11,17.
No caso em questão o único sintoma apresentado pela paciente foi a irritabilidade em alguns momentos tendo permanecido a maior parte dos dias assintomática. O diagnóstico foi feito pelas medidas de glicemias capilares na internação, sendo revertidas algumas vezes por copo de leite humano pasteurizado e após o diagnóstico por soroterapia com infusão de glicose contínua.
O diagnóstico é firmado pela combinação da clínica características com os achados laboratoriais que marcam a secreção inapropriada de insulina, mesmo em hipoglicemia. Os exames incluem principalmente as dosagens séricas de glicose, insulina e peptídeo C. Esses devem ser colhidos em vigência de hipoglicemia, quando os níveis de glicose reduzidos deveriam induzir a níveis nulos de insulina e peptídeo C. Sendo assim, os pacientes com HH, mesmo em baixos níveis de glicemia, apresentarão elevados níveis séricos de insulina e peptídeo-C 11,17. Além disso, para validar os achados dos exames, os valores de glicose plasmática devem estar abaixo dos limites da glicemia de jejum, 30mg/dL em neonatos e 20mg/dL em neonatos prematuros ou pouco desenvolvidos para a idade gestacional 11.
Em relação ao tratamento, os principais medicamentos utilizados é a associação de diazóxido com hidroclorotiazida. Em alguns casos faz-se necessário o uso de octreotida, um análogo da somatostatina que age inibindo a secreção de insulina pelo pâncreas (tabela 3) 17.
O Diazóxido, usado para o tratamento crônico, é um agonista dos canais KATP, que se liga às subunidades desses canais prolongando o tempo de abertura e evitando a despolarização da membrana, com isso não há liberação da insulina. A dose inicial de diazóxido é de 5 mg/kg/dia, administrada por via oral em 3 doses diárias, que podem ser aumentadas gradativamente em incrementos de 5 mg/kg/ dia a cada 4 dias até se alcançar uma dose efetiva e tolerável. No caso descrito, a dose inicial já foi efetiva, e, portanto, mantida na alta. O medicamento possui como efeito adverso desenvolvimento de insuficiência cardíaca congestiva e hipertensão pulmonar. Ademais, o uso em RN requer restrições de fluídos e uma coadministração de diuréticos, sendo a hidroclorotiazida o principal medicamento devido ao efeito de proporcionar um aumento da glicemia 11,17,18. Em casos que não respondem à terapia medicamentosa deve-se lançar mão da pancreatectomia 17.
Na avaliação do diagnóstico diferencial de hiperinsulinismo responsivo ao diazoxido também devemos incluir a síndrome hiperinsulinismo-hiperamonemia, que está associada a níveis bastante elevados de amônia e que não possui a mesma base genética da desordem de secreção de insulina causada pelas mutações do gene da glutamato desidrogenase. No entanto, tal acometimento se instala principalmente no período pósprandial de alimentos ricos em proteína. Sendo a redução de teores proteicos na alimentação (visando redução dos níveis de amônia), associada ao diazóxido, o tratamento de primeira escolha 8-10. Entretanto, não foi levantada a hipótese de hiperinsulinismo por hiperamonemia, pois, no caso a descrito, a hipoglicemia se ocorreu após instituído o jejum.
Além disso, é importante que sejam pesquisados erros inatos do metabolismo (EIM), pois podem cursar também com hipoglicemia. Podem ser divididos em três grupos: distúrbios de síntese ou catabolismo de moléculas complexas; erros inatos do metabolismo intermediário que culminam em intoxicação aguda ou crônica e deficiência na produção ou utilização de energia 19. Contudo, não foi realizada a investigação de EIM, pois o diagnóstico de HH havia sido firmado, não havendo necessidade de progredir com a investigação de diagnósticos diferenciais.
O caso apresentado tratou-se de hipoglicemia secundária a hiperinsulinismo congênito, confirmada pelos exames laboratoriais e pela resposta positiva ao tratamento com diazóxido e hidroclorotiazida. Apesar dos estudos mostrarem que a patologia traz repercussões sistêmicas mais severas, a paciente em questão permaneceu assintomática por toda a internação.
O hiperinsulinismo congênito deve ser incluído no diagnóstico diferencial dos recém-nascidos que apresentarem hipoglicemia durante o período neonatal. Atrasos no diagnóstico e no tratamento podem afetar a qualidade de vida futuramente desses pacientes, sendo de suma importância a avaliação de um pediatra para avaliação clínica e suspeição diagnóstica.
REFERÊNCIAS
1. Sociedade Brasileira de Pediatria. Diretrizes SBP-hipoglicemia no período neonatal. Soc Bras Pediatr. 2017;1(1):1-24.
2. Pediatrics AA of. Clinical Report-Postnatal Glucose Homeostasis in Late-Preterm and Term Infants abstract. Pediatrics. 2011;127(3):575-9.
3. Sáez J, Pattillo JC, Orellana P, Godoy Cortés C. Hiperinsulinismo congénito del recién nacido. A propósito de un caso clínico. Rev Chil Pediatr. 2017;88(3):377-82.
4. Felício JS, Martins CP, Semer M, Kalinin L, Nery M, Machado MCC, et al. Hiperinsulinismoendógeno: revisão e seguimento de 24 casos. Arq Bras Endocrinol Metabol. 2017;56(2):83-95.
5. Bordignon JS, Dedavid B, Prevedello BP, Beck EQ, Castro P, Najar L, et al. Hipoglicemia neonatal: revisão integrativa. Ciências da saúde. 2018;19(3):639-49.
6. Balachandran B, Mukhopadhyay K, Sachdeva N, Walia R, Attri SV. Randomised controlled trial of diazoxide for small for gestational age neonates with hyperinsulinaemic hypoglycaemia provided early hypoglycaemic control without adverse effects. Acta Paediatr Int J Paediatr. 2018;107(6):990-5.
7. Demirbilek H, Hussain K. Congenital Hyperinsulinism: Diagnosis and Treatment Update. J Clin Res Pediatr Endocrinol. 2017;9(2):69-87.
8. Palladino AA, Bennett MJ, Stanley CA. Hiperinsulinismo na infância: quando apenas uma dosagem de insulina não é suficiente. J Bras Patol Med Lab. 2008;44(13):413-22.
9. Del Roio Liberatore Junior R, Eduardo Martinelli Junior C. Hipoglicemia hiperinsulinêmica da infância Hypoglycemia hypersinsulinemic of infancy. Arq Bras Endocrinol Metab. 2011;55(3):177-83.
10. Rodrigues TC, Colli M, Czepielewski MA. Hipoglicemia na infância: Resultados de um protocolo de avaliação prospectiva em crianças com até 1 ano de idade. Arq Bras Endocrinol Metabol. 2007 Dec;51(9):1493-7.
11. Galcheva S, Al-Khawaga S, Hussain K. Diagnosis and management of hyperinsulinaemic hypoglycaemia. Best Pract Res Clin Endocrinol Metab. 2018;32(4):551-73.
12. Liberatore Junior RDR, Martinelli Junior CE. Hipoglicemia hiperinsulinêmica da infância. Arq Bras Endocrinol Metabol. 2011;55(3):177-83.
13. Liberatore Junior RDR, Negri AA, Martinelli Junior CE, Kochi C, Silva IN, Collett-Solberg PF. Hipoglicemia hiperinsulinêmica da infância: Análise de dados clínicos de uma amostra brasileira. Arq Bras Endocrinol Metabol. 2013;56(9):666-71.
14. James C, Kapoor RR, Ismail D, Hussain K. The genetic basis of congenital hyperinsulinism. J Med Genet. 2009;46(5):289-99.
15. Lord K, De León DD. Hyperinsulinism in the Neonate. Clin Perinatol. 2018;45(1):61-74.
16. Flanagan SE, Clauin S, Bellanné-Chantelot C, De Lonlay P, Harries LW, Gloyn AL, et al. Update of mutations in the genes encoding the pancreatic beta-cell KATP channel subunits Kir6.2 (KCNJ11) and sulfonylurea receptor 1 (ABCC8) in diabetes mellitus and hyperinsulinism. Hum Mutat. 2009;30(2):170-80.
17. Medeiros VF. Persistent Hyperinsulinemic Hypoglycemia in Neonates : a review. Ciência em Mov. 2014;2(33):57-68.
18. Galcheva S, Demirbilek H, Al-Khawaga S, Hussain K. The Genetic and Molecular Mechanisms of Congenital Hyperinsulinism. Front Endocrinol (Lausanne). 2019;10(February):1-18.
19. Souto A, Husny EL, Fernandes-Caldato MC. Erros inatos do metabolismo: revisão de literatura. Rev Para Med. 2006;20(2):41-5.







